某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O,
(1)、请将Au2O3之外的反应物与生成物分别填入以下空格内。
Au2O3 + + → + + 。
(2)、反应中被还原的元素是 ,还原剂是 。
(3)、将氧化剂和还原剂填入下列空格中,并标出电子转移的方向和数目。
+ +……
(4)、纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl ,则还原剂与氧化剂物质的量之比为 。
现有以下物质: ①NaCl溶液②CO2③H2SO4④Cu⑤HNO3⑥蔗糖⑦酒精⑧ HCl ,其中属于电解质的是:(填序号,下同);属于非电解质的是:;属于一元酸的是:。
① HNO3的摩尔质量是_______,0.5mol HNO3的质量是,1.5mol HNO3含有_____mol氧原子。
② 标准状况下11.2L CO2的物质的量是。
孔雀石主要含Cu2(OH)2CO3,还含少量杂质FeO、Fe2O3、SiO2。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:



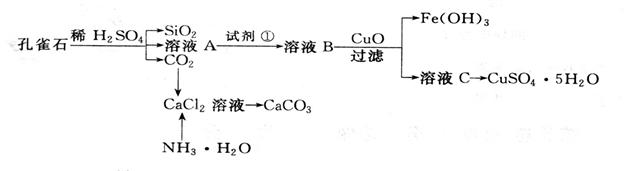

 请回答下列问题:
请回答下列问题: (1)溶液A的金属离子有__________。检验溶液A中Fe3+的最佳试剂为
(1)溶液A的金属离子有__________。检验溶液A中Fe3+的最佳试剂为  A、KMnO4 B、(NH4) 2S C、H2O2 D、KSCN
A、KMnO4 B、(NH4) 2S C、H2O2 D、KSCN  (2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。 (3)制备CaCO3时,应向CaCl2溶液中先加入NH3.H2O,然后通入CO2,反应的方程式:__________________________________________________________________。
(3)制备CaCO3时,应向CaCl2溶液中先加入NH3.H2O,然后通入CO2,反应的方程式:__________________________________________________________________。


 (4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
(5)探究氧化铜的性质:取A、B两支试管,往A中加入适量的CuO粉末,再分别向A和B加入等体积3% H2O2溶液,只观察到A中有大量气泡,结论是:。
在某个容积为2 L的密闭容器内,在T1℃时按下图1所示发生反应:
mA(g)+nB(g)  pD(g)+qE(s),DH<0(m、n、p、q为最简比例的整数)。
pD(g)+qE(s),DH<0(m、n、p、q为最简比例的整数)。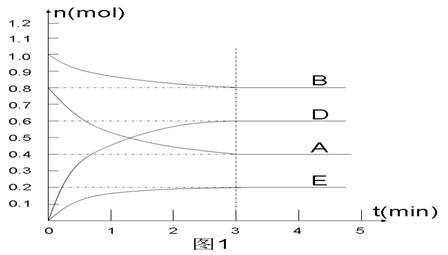
(1)据图1所示,反应开始至达到平衡时,用D表示该反应速率为_____________;
(2)该反应的化学平衡常数K的表达式为________________________________;
(3) 下列措施能增大B的转化率的是 ()
| A.升高温度 |
| B.保持体积不变通入1molB |
| C.保持体积不变移出部分物质D(g) |
| D.将容器的容积增大为原来2倍 |
E. 保持体积不变通入1mol A
(4) 反应开始时向容器中通入一定量的A和B,反应达到平衡时,测得D的浓度为0.6 mol.L-1。(图2中纵坐标为D的浓度)
①请用实线在下图坐标系中该表示平衡的建立过程。
②若该反应在T2℃(T2> T1)温度下进行,请用虚线画出该平衡的建立过程。
某芳香烃A有如下转化关系: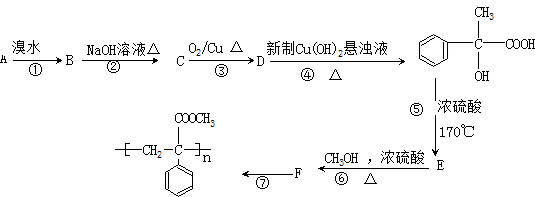
回答下列问题:
(1)写出反应类型:①,⑥
(2)写出结构简式:A,F
(3)下列有关F的描述正确的是()
| A.属于芳香烃类化合物 | B.能发生取代反应 |
| C.能使溴水和KMnO4溶液褪色 | D.能发生加聚反应 |
(4)写出反应的化学方程式:⑦