(一)实验方法测定反应热---------中和热测定
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)他们记录的实验数据如下:
| 实 验 用 品 |
溶 液 温 度 |
中和热△H |
|||
| t1 |
t2 |
||||
| ① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
| ② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
计算完成上表。△H=
(3)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
研究小组做该实验时环境温度 (填“高于”、“低于”或“等于”)22 ℃,此反应所用NaOH溶液的浓度应为 mol/L。
(二)通过化学计算间接获得
(1)已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。
则反应H2(g)+I2(g)=2HI(g)的反应热△H= kJ·mol-1
(2)已知:2H2(g)+ O2(g) = 2H2O (l) △H=-571.6 kJ·mol-1
H2(g)+1/2O2(g) = H2O(g) △H=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为 kJ·mol-1;
回收利用印刷电路板上的铜制备铜的化合物,实现资源的再利用。
(1)回收利用印刷电路板上的铜制备CuCl2。
实验室模拟回收过程如下: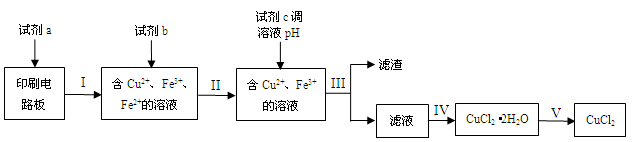
已知部分物质开始沉淀和沉淀完全时的pH如下表:
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)2 |
7.6 |
9.6 |
| Fe(OH)3 |
2.7 |
3.7 |
| Cu(OH)2 |
4.4 |
8.0 |
请回答下列问题:
①步骤III的操作名称是。
②下列试剂中,可以作为试剂a的是。
A.HNO3溶液B.Fe2(SO4)3溶液C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?(填“是”或“否”),理由是。
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜。
已知:2H2O2(l)=2H2O (l) +O2(g)△H1=-196kJ/mol
H2O(l)=H2(g) +1/2O2(g)△H2=+286kJ/mol
Cu(s) +H2SO4(aq)=CuSO4(aq) +H2(g)△H3=+64kJ/mol
则Cu(s) +H2O2(l) +H2SO4(aq) =CuSO4(aq) +2H2O(l) △H =。
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是。
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5 mol/L的硝酸溶液的体积是L。
X、Y、Z、R为前四周期元素,原子序数依次增大。X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满。
请回答下列问题:
(1)Z3+离子的核外电子排布式是。
(2)科学家成功地在高压下将XY2 转化为具有类似SiO2结构的原子晶体,该晶体中X原子的杂化轨道类型是;X、Z、R的单质分别与足量Y2充分反应所得产物的熔点由高到低的顺序是。(填化学式)
(3)由Y、R形成的某化合物的晶胞结构如图所示,其化学式是。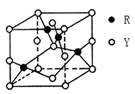
(4)常温下,pH相同的NaZY2与Na2XY3两种溶液,物质的量浓度较大的是。(填化学式)
(5)将亚硫酸钠的水溶液逐滴加入RCl2的水溶液中,再加入少量浓盐酸混匀,得到难溶的白色沉淀RCl,该反应的离子方程式是。
(13分)有A、B、C、D、E、F、G、H八种原子序数依次增大的元素(原子序数均小于30)。A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,A、E同主族,F的基态原子s能级的电子总数与p能级的电子数相等,B、G同族,H的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)H元素在周期表中属于区。G的基态原子电子排布式为CD2中C的杂化类型是___________
(2)下列说法不正确的是。
a.B2A2分子中含有σ键和π键
b.B2A2分子的沸点明显低于A2D2分子
c.A2D2分子的空间构型为直线形
d.B、C、D的电负性由大到小的顺序为D>C>B
e.B、C、D的第一电离能由大到小的顺序为D>C>B
f.H2+能与BD分子形成[H(BD)4]2+,其原因是BD分子中含有空轨道
g.B和G的单质能形成相同类型的晶体,其熔点B > G
(3)由B、F、H三种元素形成的一种具有超导性的晶体,B位于F和H原子紧密堆积所形成的空隙当中。晶胞如图所示,该晶体的化学式为___________
(4)CD2、D2和熔融ECD3可制作燃料电池,其原理如下图所示。该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,石墨Ⅰ电极反应式为___________
X、Y、Z、W为短周期元素且原子序数依次增大。X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上。Y2-的M能层的原子轨道为全空状态。Z的单质用作铝热反应的引燃剂。W与X形成的化合物是一种常见的有机溶剂n。A为第四周期元素,其基态原子含有6个未成对电子。
请回答下列问题:
(1)X在元素周期表中的位置是。
(2)A3+的外围电子排布式是。
(3)X、Y、Z形成的晶胞结构示意图如下,则它的化学式是。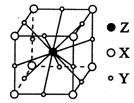
(4)m分子中,X的原子轨道杂化类型是,n的分子构型是。
(5)气体m和含A2Y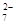 的酸性溶液,可通过惰性电极连接构成高能原电池,该电池的正极反应式是。
的酸性溶液,可通过惰性电极连接构成高能原电池,该电池的正极反应式是。
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)e的基态原子电子排布式为_______。
(2)b、c、d的第一电离能由大到小的顺序是_________(填元素符号)
(3)a和其他元素形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物是________(填化学式)。
(4)d与c可以形成两种分子,低价态分子中心原子的杂化方式为_______该分子的空间构型为______________
(5)e和c形成的一种离子化合物的晶体结构如图,则该离子化合物的化学式为__________。(填元素符号)