现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸的浓度为4mol/L,稀硝酸的浓度为2 mol/L。取10mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收集到的气体成分为 、 ;体积分别是 L、 L。(假设HNO3只被还原为NO)
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2CuCl+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):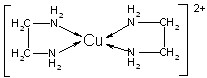
请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为,
H、N、O三种元素的电负性由大到小的顺序是;
(2)SO2分子的空间构型为;
(3)乙二胺分子中氮原子轨道的杂化类型为,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是。
(4)配离子[Cu(En)2]2+的配位数为,该微粒含有的微粒间的作用力类型有(填字母);
| A.配位键 | B.极性键 | C.离子键 | D.非极性键 |
E.氢键 F.金属键
(5)CuCl的晶胞结构如右图所示,其中Cl-的配位数(即与Cl-最近距离的Cu+的个数)为。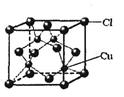
根据下列变化关系: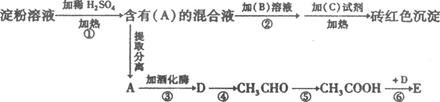
请填空:
(1)A物质的名称_____ 。B溶液为____________.作用为_________________________
(2)写出④、⑥两步反应的化学方程式,在( )号中标明反应类型。
④ ________________________________________( )
⑥_______________________________________( )
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两种元素的原子核外电子数之和等于B原子的质子数,B2-的结构示意图为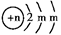 ,请回答下列问题:
,请回答下列问题: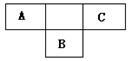
(1)写出A、B、两种元素的符号:A ,B。
(2)B位于周期表中第周期第族。
(3)C的氢化物的电子式为;
(4)BC6作致冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的致冷剂,且BC6在温度高于45度以上时为气态,BC6属于(填“离子”、“共价”)化合物。
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是______________。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将______(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500 s内N2O5的分解速率为________________。
③在T2温度下,反应1000 s时测得NO2的浓度为4.98 mol·L-1,则T2________T1。(填>、<或=)
(3)如右图所示装置可用于制备N2O5,则N2O5在电解池的______区生成,其电极反应式为_______。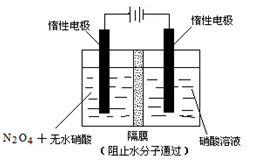
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为−285.8kJ·mol-1、−283.0kJ·mol-1和−726.5kJ·mol-1。
请回答下列问题:
(1)常温下用太阳能分解10mol液态水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___________;
(3)在容积为2L的密闭容器中,由CO和H2合成甲醇,在其他条件不变的情况下,考查温度对反应的影响,实验结果如右图所示(注:T1、T2均大于300℃);下列说法正确的是_______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=  mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时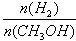 增大
增大