、能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)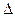 H1
H1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)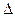 H2
H2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”);
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断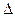 H1 0(填“>”“=”或“<”);
H1 0(填“>”“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为 .
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应Ⅰ进行甲醇合成,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应 到某时刻测得各组分的浓度如下:
到某时刻测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
①比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)。
②若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
(3)生产过程中,合成气要进行循环,其目的是 。
(1)有一种金属结构单元是一个“面心立方体”(注:八个顶点和六个面分别有一个金属原子),该单元平均是由个金属原子组成的。
(2)如果有一种立方晶胞中每个顶点、面心、边心、体心都各有一个金属原子,则此晶胞有个金属原子。
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素原子的L层电子排布式为________,W3分子的空间构型为________;
(2)X单质与水发生主要反应的化学方程式为________________;
(3)化合物M的化学式为________,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是________。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有________,O—C—O的键角约为________;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X∶Y∶Z=________;
(5)含有元素Z的盐的焰色反应为________色。许多金属盐都可以发生焰色反应,其原因是___________________。
已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大。G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列。
回答下列问题:
(1)Z的核外外围电子排布式是____________________________________________。
(2)X以及与X左右相邻的两种元素,其第一电离能由小到大的顺序为____________(填元素符号)。
(3)QR2分子中,Q原子采取________杂化,写出与QR2互为等电子体的一种分子的化学式:____________。
(4)分子式为G 2R、G 2Y的两种物质中一种更稳定,原因是_____________;T的氯化物的熔点比Q的氯化物的熔点高,原因是___________________。
(5)据报道,由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如下图所示。晶体中距每个X原子周围距离最近的Q原子有______个。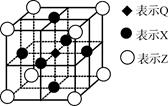
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为,该元素的符号是;
(2)Y元素原子的价层电子的轨道表示式为,该元素的名称是;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程是;
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由。
A、B、C、D、E五种微粒,它们可能是原子或离子,并且所含的元素都在短周期。A显负价时,不能被任何氧化剂氧化;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有10个电子,E极易与C+结合成中性微粒。回答:
(1)写出五种微粒的符号:A、B、C、D、E。
(2)C的同位素名称:C2。
(3)C和D形成分子的电子式为,空间结构为。