卤块的主要成分是MgCl2,此外还含有少量的Fe3+、Fe2+和Mn2+等离子。以卤块为原料制取轻质氧化镁工艺以及相关数据如下: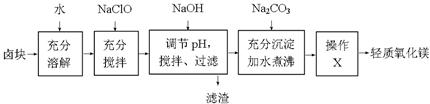
常温下生成氢氧化物沉淀的pH数据:
| 物 质 |
开始沉淀时的pH |
沉淀完全时的pH |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
| Mg(OH)2 |
9.6 |
11.1 |
回答下列问题:
(1)加入NaClO后产生少量红褐色沉淀。写出加入NaClO后发生的离子反应方程式:_____________________。
(2)为尽量除去杂质,用NaOH调节pH。当溶液pH为________ 时,停止加入NaOH。
(3)流程图中操作X是_______________。
(4)加入Na2CO3后,加水煮沸的化学方程式为_________________________________。向除去Fe3+、Fe2+和Mn2+等离子后的滤液中改加Na2CO3,而不继续加入NaOH,你认为可能的原因是___________________ __ 。
资料1:精制碘盐的成分为NaCl和KIO3,其中碘的含量为20~40mg·kg-1。
资料2:日本地震导致福岛两座核电站反应堆发生故障,铯和碘的放射性同位素大量外泄。
资料3:专家认为,每天服用1片碘片(含碘量100mg)可有效减小人体甲状腺对放射性碘的吸收。
请认真阅读以上资料,并回答下列问题:
(1)铯在周期表中的位置是。
(2)下列物质中与KIO3属于同一类物质的是(填序号)。
①HIO3②碘酸钠③KOH④I2O5⑤NaCl
(3)向碘盐的溶液中加入白醋和KI,再滴入淀粉溶液,溶液呈蓝色,则发生反应的离子方程式为。
(4)若用精制碘盐来预防放射性碘对人体的伤害,是否可行?(填“行”、“不行”),原因是。
(12分)工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。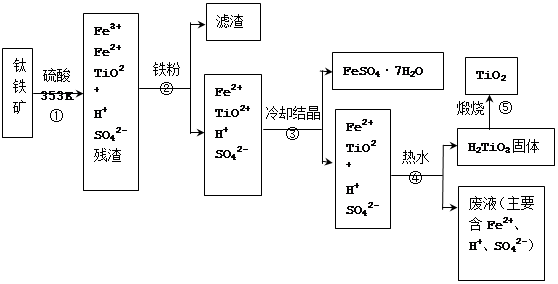
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为。
(2)步骤③中,实现混合物的分离是利用物质的(填字母序号)。a. 熔沸点差异 b. 溶解性差异 c. 氧化性、还原性差异
(3)步骤②、③、④中,均需用到操作是(填操作名称)。
(4)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),则反应的离子方程式为。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极所发生反应的电极反应式:。
②在制备金属钛前后,CaO的总量不变,其原因是
(请结合化学用语解释)
丙烷在燃烧时能放出大量的热,它是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g) +7O2(g) =" 6CO(g)" + 8H2O(l)△H1= -2741.8kJ/mol
②2CO(g) + O2(g) = 2CO2(g)△H2= -566kJ/mol
(1)反应C3H8(g) +5O2(g) = 3CO2(g) +4H2O(l)的△H=
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g) + H2O(g)  CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)=,此过程吸收的热量为________________________.
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由____极移向____极(填“正”或“负”);电池的负极电极反应式为。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____。
请按指定要求完成下列问题。
⑴向酸性高锰酸钾溶液中通入二氧化硫气体,高锰酸钾被还原为硫酸锰(请书写离子方程式)___________________。
⑵向酸性硫酸亚铁溶液中滴加过量双氧水(请书写离子方程式)_____________________。
⑶向溴化亚铁溶液中通入等物质的量的氯气(请书离子方程式)__________________。
⑷将四氧化三铁溶于过量的稀硝酸(请书写离子方程式)__________________________。
⑸乙醇被硫酸酸化的重铬酸钾溶液氧化成乙酸,重铬酸钾被还原为硫酸铬(请完成化学方程式)_______________。
⑹S + NaOH = Na2Sx + Na2S2O3 + H2O (用含x的代数式配平方程式,并标出电子转移的方向和数目)_________________________________________________________________
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃
时反应可生成它.CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应
能生成一种单质气体;Cu+在酸性条件下发生的反应是:2Cu+===Cu2++Cu.
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作_______(填“氧化剂”或“还原剂”).
(2)写出CuH在氯气中燃烧的化学反应方程式:_______________________.
(3)CuH溶解在足量稀盐酸中生成的气体是______(填化学式);
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量
稀硝酸中反应的离子方程式:________________________________________.