(10分)
(1)6.02×1023个CO2与 molH2质量相等,与 gSO2含有的原子个数相等;
(2)含0.4molCl的氯化镁是 mol,质量是 g,它跟 g氯化钠含有相同数目的Cl;
(3)4molNa2CO3与 molNa2SO4所含氧原子数相等;
(4)8g的甲烷是 mol,约含 个甲烷分子, g碳元素, mol氢原子。
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:
N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol。
2NH3(g)△H=-92.4kJ/mol。
(1)实验室中常用来制备氨气的化学方程式为 。
(2)已知H2(g)的燃烧热为285.8kJ•mol-1,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式 _。
(3)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__________________(填“正向”、“不”或“逆向”)移动,所滴加稀氨水的物质的量浓度为_____________mol•L-1(25℃时,NH3•H2O的电离平衡常数Kb≈2×10-5)。
(4)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2 ]:CO2(g)+2NH3(g) CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10mol CO2和0.40mol NH3,70min开始达到平衡。反应中CO2(g)的物质的量随时间变化如下表所示:
CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10mol CO2和0.40mol NH3,70min开始达到平衡。反应中CO2(g)的物质的量随时间变化如下表所示:
| 时间/min |
0 |
30 |
70 |
80 |
100 |
| n(CO2)/mol |
0.10 |
0.060 |
0.040 |
0.040 |
0.040 |
①20min时v正(CO2)_________80min时v逆(H2O)(填“>”、“=”或“<”)。在t℃时,该反应的平衡常数K= 。
②在100min时,保持其它条件不变,再向容器中充入0.050mol CO2和0.20mol NH3,重新建立平衡后CO2的转化率与原平衡相比将_________(填“增大”、“不变”或“减小”)。
③根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变,则(t+10)℃下正确的图象可能是 (填图甲中的“A”或“B”)。
④图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素[CO(NH2)2]的碱性溶液制取氢气。该装置中阳极的电极反应式为______ ,若两极共收集到气体22.4L(标况),则消耗的尿素为______g(忽略气体的溶解)。
如图所示的电解装置中,乙池盛有200mL饱和CuSO4溶液,丙池盛有200mL饱和NaCl溶液.通电一段时间后,C极增重0.64g,则: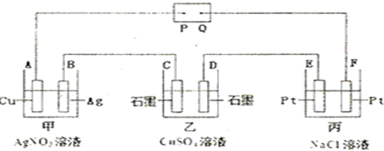
(1)P是电源的_________极。甲池中,A极的质量_________g。电解一段时间,甲池溶液的pH为_________。(2)D极的电极反应式为 ,丙池电解反应的总离子方程式为 。
相同状况下,D电极与E电极产生的气体体积比为_______________。
(3)若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度。则电解过程中转移电子的数目为__________________。(用NA表示)
25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因 (用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)__0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填>、<、=)
(3)求出混合液中下列算式的精确计算结果(填具体数字):c (Na+)-c (A-)= mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7 (填>、<、=);
(5)将相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3 | B.NH4A | C.(NH4)2SO4 | D.NH4Cl |
按pH由大到小的顺序排列 (填序号)
(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释至100mL,稀释后的溶液中c(H+)/c(OH-)=___________________。
(2)某温度时,测得0. 01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数KW=_______。该温度___________25℃。
(3)在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va:Vb=____________
②若所得混合液的州pH=10,且a=12,b=2,则Va:Vb=____________
铁铜单质及其化合物的应用范围很广。现有含氯化亚铁杂质的氯化铜晶体,为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯:
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| Fe3+ |
Fe2+ |
Cu2+ |
|
| 开始沉淀的pH |
1.9 |
7.0 |
4.7 |
| 完全沉淀的pH |
3.2 |
a |
6.7 |
请回答下列问题:
(1)化学上通常认为残留在溶液中的离子浓度小于1×10﹣5mol/L时,沉淀就达到完全。已知Fe(OH)2的Ksp约为1.0×10﹣15,则a= 。
(2)加入氧化剂的目的是 ,X应选择 。
A.K2Cr2O7 B.浓HNO3 C.H2O2 D.KMnO4
(3)加入的物质Y是 。
(4)设计实验从溶液Ⅲ中获得纯净的CuCl2•2H2O。简要描述实验步骤 。