铁铜单质及其化合物的应用范围很广。现有含氯化亚铁杂质的氯化铜晶体,为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| |
Fe3+ |
Fe2+ |
Cu2+ |
| 开始沉淀的pH |
1.9 |
7.0 |
4.7 |
| 完全沉淀的pH |
3.2 |
a |
6.7 |
请回答下列问题:
(1)化学上通常认为残留在溶液中的离子浓度小于1×10﹣5mol/L时,沉淀就达到完全。已知Fe(OH)2的Ksp约为1.0×10﹣15,则a= 。
(2)加入氧化剂的目的是 ,X应选择 。
A.K2Cr2O7 B.浓HNO3 C.H2O2 D.KMnO4
(3)加入的物质Y是 。
(4)设计实验从溶液Ⅲ中获得纯净的CuCl2•2H2O。简要描述实验步骤 。
卤族元素是典型的非金属元素,卤素单质及其化合物在工农业生产和生活中都有重要的用途。
(1)同主族元素的电负性大小存在一定的规律,卤族元素(F、Cl、Br、I)中,电负性最大的是 。
(2)不同卤素原子之间可形成卤素互化物,如IBr、BrI3、BrF5、IF,等。卤素互化物中的化学键类型是 (填标号)。
| A.极性键 | B.非极性键 | C.离子键 | D.σ键 |
(3)BeCl2的分子空间构型为__________;BF3分子中B-F键的键角为_____________。
(4)CCl4分子中的C原子和NF3分子中的N原子的杂化方式是否相同? 。如果相同,则其杂化方式为 ;如果不相同,则其杂化方式分别为 。(后两个空只能填一个,若两空都填,则不给分)
(5)HF的相对分子质量小于HC1,但其沸点却高于HC1,其原因是________________
(6)由F、Mg、K三种元素形成的某种晶体的晶胞结构如下图所示,晶胞边长为anm,该晶体的化学式为_________________________;列式计算该晶体的密度(g.cm-3)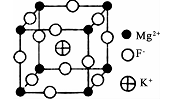
2015年9月20日“长征六号”运载火箭成功将20颗微小卫星送入太空,创造了中国航天一箭多星的新纪录。“长征六号”运载火箭采用无毒环保的过氧化氢一煤油为推进剂。
(1)石油经过 可获得汽油、煤油、柴油、重油等,通过将重油_______可获得更多的汽油、煤油等轻质油。
(2)煤油中的主要组成元素是 (填元素符号)。
(3)在H2O2水溶液中加入少量MnO2粉末时迅速产生大量气泡,该气体能使带火星的木条复燃,该反应中,还原产物是 (填化学式),每产生1mol气体时转移电子的物质的量为__________。
(4)H2O2不稳定,下列各表为在不同条件下1h内H2O2的分解率(均以质量分数为30%的H2O2溶液开始实验):
①在60℃、pH=3.1条件下,H2O2的分解速率为__________mol/(L·min)(已知30%的H2O2溶液的密度为1.11 g/cm3,反应过程中溶液体积变化忽略不计,计算结果保留两位有效数字)。
②结合表中的规律,推测H2O2在下列条件下分解速率依次增大的顺序为_____________(填标号)。
a.30℃、pH =13.0,H2O2溶液的质量分数为30%
b.70℃、pH=9.0,H2O2溶液的质量分数为30%
c.70℃、pH =13.0,H2O2溶液的质量分数为30%
硒鼓回收料含硒约97%,其余为约3%的碲和微量的氯。从该回收料中回收硒的工艺流程如下图所示(已知煅烧过程中,回收料中的硒、碲被氧化成SeO2和TeO2):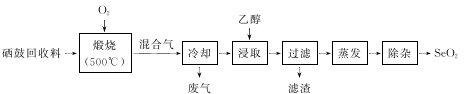
部分物质的物理性质如下表:
回答下列问题:
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为第 周期,第 族;H2 SeO4的酸性比H2SO4的酸性 (填“强”或“弱”)。
(2)实验中往往需将硒鼓回收料粉碎,其目的是
(3)乙醇浸取后过滤所得滤渣的主要成分是_____________。蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是______________________。
(4)以SO2为还原剂可将SeO2还原为单质硒,写出反应的化学方程式:________________________
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:2H2O(g) 2H2(g)+O2(g)△H = +484kJ·mol—1,不同时段产生O2的量见下表:
2H2(g)+O2(g)△H = +484kJ·mol—1,不同时段产生O2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
上述反应过程中能量转化形式为光能转化为 能,达平衡过程中至少需要吸收光能为 kJ。
(2)现有反应:CO(g)+ H2O(g)  CO2(g)+ H2(g) △H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO2(g)+ H2(g) △H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| 物质的量 |
CO |
H2 O |
CO2 |
H2 |
| 甲 |
a mol |
a mol |
0 mol |
0 mol |
| 乙 |
0mol |
0 mol |
2a mol |
a mol |
| 丙 |
0 mol |
0 mol |
a mol |
a mol |
| 丁 |
a mol |
a mol |
a mol |
a mol |
上述四种情况达到平衡后,甲、乙、丙、丁容器中n(CO)的大小顺序为 。
(3)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3得金属钨,总反应为WO3 (s) + 3H2 (g) W (s) + 3H2O (g)。请回答下列问题:
W (s) + 3H2O (g)。请回答下列问题:
①某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为 。
②上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 |
25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 |
WO3W2O5WO2 W |
假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
③钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) WI4 (g)。下列说法正确的有 (填字母)。
WI4 (g)。下列说法正确的有 (填字母)。
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)。
2Cl2(g)+2H2O(g)。
(1)研究表明反应A通过如下图所示的催化剂循环实现。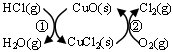
反应①为:2HCl(g)+CuO(s) H2O(g)+CuCl2(g) ΔH1
H2O(g)+CuCl2(g) ΔH1
反应②生成1molCl2(g)的反应热为ΔH2,则A反应的反应热表示为 。(用ΔH1和ΔH2表示)。
(2)反应A中,4mol HCl被氧化,放出115.6kJ的热量,且部分化学键断裂示意图如下: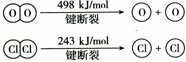
①H2O的电子式是 ,反应A的热化学方程式是 。
②断开1 mol H—O键与断开 1 mol H—Cl 键所需能量相差约为 kJ,H2O中H—O 键比HCl中H—Cl键 (填“强”或“弱”)。
(3)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。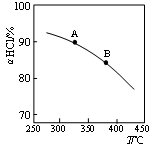
实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的ɑHCl—T曲线如上图所示,若压缩体积使压强增大,画出相应ɑHCl—T曲线的示意图,并简要说明理由 。