(1)①在配制FeCl3溶液时,常在溶液中加入一些_________________以抑制其水解;其水解反应的离子方程式为
②用Al2(SO4)3与NaHCO3溶液混合反应就是泡沫灭火器的工作原理,请写出反应的离子方程式________________________________________________________。
③请按顺序排列出1mol/LNH4Cl溶液中各种离子浓度大小关系_________。请详细解释该溶液呈现酸性、碱性或中性的原因_______________________ 。
(2)25℃时,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得溶液的pH=10。试回答以下问题:
所得溶液中由水电离出的c(H+)________0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(3)将相同温度下相同浓度的下列溶液:
| A.HCl | B.CH3COOH | C.NH4Cl | D.CH3COONa E.NaOH F.NaCl |
按pH由大到小的顺序排列 (填序号)
(4)加热蒸干AlCl3溶液得到 ;接下来灼烧得 ;(填化学式)
用离子方程式及简短的文字说明原因
(8分)W、X、Y、Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为3:8;X的核外电子总数与Y的最外层电子数相等,X的原子序数是Z的原子序数的一半;W、Y、Z位于同一周期。
(1)W的单质是一种_________色晶体。
(2)W、Y、Z三种元素的气态氢化物稳定性由高到低的顺序是(用化学式表示,Z的气态氢化物与其同主族元素气态氢化物化学式写法相似。)。
(3)已知A、B、C、D四种物质存在如下反应关系:
A + B→C + D
①若A是Y和Z常见价态的化合物,B是X的氢化物,D是Y的氢化物,反应过程中没有化合价变化,该反应的化学方程式是。
②若A是Z的单质,B为红色固体,D为紫红色固体单质,高温下发生该反应,C的化学式是。D与X元素最高价氧化物对应水化物的浓溶液反应,生成的气体会对大气造成污染。用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程式是。
氯及其化合物是中学化学中的重要研究对象。
(1)写出实验室中制取氯气的离子方程式;
(2)实验室也可以利用如下反应制取氯气:KC1O3+6HC1(浓)KC1+3C12↑+3H2O。若制取标准状况下的6.72L氯气,该反应中电子转移的物质的量为;
(3)某同学用排空气法收集一瓶氯气,进行氯气与铁反应的实验:取一根细铁丝,然后立即伸入充满氯气的集气瓶中,观察到的现象是。为观察生成的氯化铁溶液的颜色,向反应后的集气瓶中加入少量的蒸馏水,振荡,实际观察到的现象是,产生这种现象的原因是;为真正观察到氯化铁溶液的颜色,应向反应后的集气瓶中改加(填试剂名称)。
.C70分子是形如椭球状的多面体,该结构的建立基于以下考虑: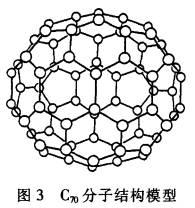
(1)C70分子中每个碳原子只跟相邻的3个碳原子形成化学键;
(2)C70分子中只含有五边形和六边形;
(3)多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2。
根据以上所述确定:
(1)C70分子中所含的单键数和双键数;(2)C70分子中的五边形和六边形各有多少?
如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有、个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是。该物质的化学式可表示为。
(3)若钙、钛、氧三元素的相对质量分别为a,b,c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为g/cm3。
二氧化硅晶体是立体的网状结构。其晶体模型如图所示。认真观察晶体模型并回答下列问题:
(1)二氧化硅晶体中最小的环为元环。
(2)每个硅原子为个最小环共有。
(3)每个最小环平均拥有个氧原子。