可以将氧化还原反应2H2+O2=2H2O设计成原电池。(每空2分)
(1)利用H2、O2、HCl溶液构成燃料电池,则正极的电极反应式为_______________;负极的电极反 应式为________________。
(2)把H2改成CH4,KOH溶液作电解质,则负极的电极反应式为_______________,当导线中通过4 mol电子时,需消耗______mol的KOH;将4 mol CH4完全与Cl2发生取代反应,并生成等物质的量的四种氯代物,则理论上需要消耗Cl2的物质的量为_______mol。
下表是元素周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
| 周期 族 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
Ⅷ |
| 1 |
A |
|||||||
| 2 |
B |
C |
L |
|||||
| 3 |
E |
F |
G |
D |
||||
| 4 |
H |
I |
(1)E和G形成的化合物的电子式______________,属于_____________化合物(“共价化合物”或者“离子化合物”)
(2)ABCEFGL中原子半径由大到小排列顺序___________________________(填写元素符号)
(3)ABCDEFGHIL中金属性最强_________非金属性最强__________化学性质最稳定的是________(填元素符号)
(4)F的单质与H的最高价氧化物的水化物反应的离子方程式________________________________。
(5)ABEL形成的化合物______在生活中常被用来制作面包的发酵剂请写出相关化学反应方程式_________。该化合物也能与E的最高价氧化物的水化物反应,请写出相关离子反应方程式____________________。
(13分)根据下列有机物的结构完成问题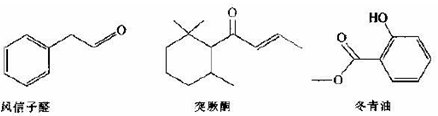
(1)可鉴别风信子醛和冬青油的试剂是 。
(2)下列关于冬青油和突厥酮的说法中正确的是 (填序号)。
| A.都属于芳香族化合物 | B.都能使酸性高锰酸钾溶液褪色 |
| C.突厥酮的分子式为C13H20O | D.都能发生水解反应 |
(3)突厥酮与溴水反应的化学方程式为 。
(4)写出符合下列条件的风信子醛的同分异构体的结构简式______(任写一种);
a.含有苯环,苯环上有两个支链
b.与新制氢氧化铜浑浊液共热无砖红色沉淀芳香烃
由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为 。在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是 (填标号)。
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
②1个 (HB=NH)3分子中有 个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为 。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为 。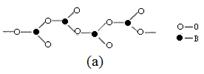
2012年8月24日,武汉市一家有色金属制造厂发生氨气泄露事故。已知在一定温度下,合成氨工业原料气H2制备涉及下面的两个反应:
C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);
CO(g)+H2O(g) H2(g)+CO2(g)。
H2(g)+CO2(g)。
(1)判断反应CO(g)+H2O(g) CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
A.容器内压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(2)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g)  2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。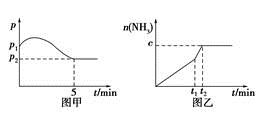
①若图中c=1.6 mol,则改变的条件是________(填字母);
②若图中c<1.6 mol,则改变的条件是__________(填字母);此时该反应的平衡常数____________。(填字母)(填“增大”、“减小”、“不变”)
A.升温
B.降温
C.加压
D.减压
E.加催化剂
(3)如(2)题中图甲,平衡时氢气的转化率为________。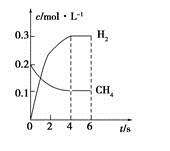
(4)工业上可利用如下反应:H2O (g)+CH4 (g)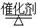 CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
X、Y、Z、E、F,5种短周期元素,它们的原子序数依次增大,X的原子半径最小,Y和Z在同周期,Z的L层电子书是K层电子数的三倍,E是短周期元素中金属性最强的元素,F和Z同主族,它们的最外层电子数和为18。请回答下列问题:
(1)X、Y、Z、E、F的原子半径从大到小的顺序为______________________(请填写元素符号)。
(2)Z、F的非金属性强弱比较_______________________(填写元素符号)Y和F的最高价氧化物的水化物的酸性大小比较____________________(填写化学式)。
(3)XYZE四种元素形成的化合物是______________(化学式),俗名为_________,请写出该化合物与E的最高价氧化物的水化物反应的离子反应方程式____________________________________。
(4)元素Y与元素Z以原子数比为1:2化合形成的化合物M,元素X和元素Z元素以原子数比为2:1化合形成的化合物Q, E与元素Z以原子个数比为1:1化合形成的化合物N,以M、Q都可以和N反应可以作为潜水艇和航空飞船的供氧剂,写出该反应的化学方程式________________、_________________。