用一种试剂除去下列各物质中的杂质(括号内的物质)。写出所用试剂及离子方程式。
(1)BaCl2(HCl):试剂 ,离子方程式 。
(2)O2(CO2):试剂 ,离子方程式 。
(3)SO42-(CO32-):试剂 ,离子方程式 。
(4)Cu粉(Al粉):试剂 ,离子方程式 。
以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O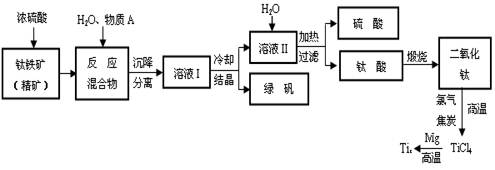
回答下列问题:
⑴钛铁矿和浓硫酸反应属于(选填“氧化还原反应”或“非氧化还原反应”)。
⑵上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是。
⑶反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是。
⑷由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g) ΔH1 =" -72" kJ·mol-1
TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g) ΔH2 =+38.8kJ·mol-1
C(s)+CO2(g)=2CO(g)ΔH3 =+282.8kJ·mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行的原因是。
②反应C(s)+O2(g)=CO2 (g)的ΔH=。
实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下: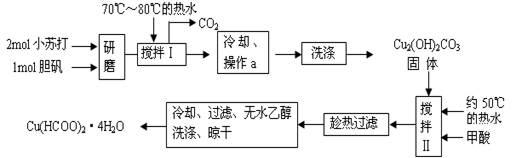
回答下列问题:
(1)生成碱式碳酸铜[Cu2(OH)2CO3]的离子方程式为。
(2)操作a的名称是,该操作使用的玻璃仪器有。
(3)证明碱式碳酸铜沉淀已经洗涤充分的实验操作是;“趁热过滤”的原因是;
(4)用无水乙醇洗涤晶体的目的是。
铝土矿的主要成分是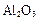 ,还含有
,还含有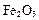 、
、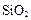 等杂质。
等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:
(1)试剂A是 ;溶液b与试剂B反应的离子方程式为 。
(2)向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是 。
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)电解时,阳极的电极反应方程式为 ;每生产0.324吨铝,理论上转移电子的物质的量为 mol。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法: 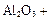
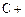
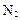

 CO(请配平)
CO(请配平)
②氯化铝与氨气高温合成法: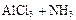


(5)方法②比方法①在生产上更具优势。下列说法中,正确的是 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
市售氯化钾中所含杂质以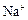 和
和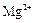 为主,也含有少量
为主,也含有少量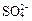 、
、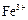 等。提纯过程如下:
等。提纯过程如下: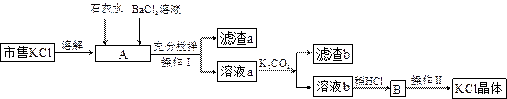
(1)操作I所用的玻璃仪器有 ;操作II的主要步骤是 。
(2)滤渣b的主要成分是 。
(3)检验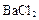 溶液是否加入过量,其详细操作过程为 。
溶液是否加入过量,其详细操作过程为 。
(4)产品KCl晶体可能仍含少量的NaCl,检验的方法是 ,进一步提纯的方法是 。
【化学—有机化学基础】
已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2;有机物B与A相对分子质量相同,A和B之间能发生酯化反应,生成有机物C;B烃基上的一氯取代产物有3种。请回答下列问题:
(1)C的结构简式是 ______________________;
(2)有机物B在Cu作催化剂的条件下与O2 反应生成D,有机物E是D的氧化产物,F是E的一种同分异构体,F可发生如下图所示的转化,其中Y的分子式为C6H8O4且分子中含有一个由六个原子构成的环。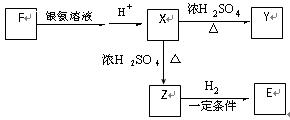
①写出F的结构简式_____________________;
②写出由X生成Y的化学方程式________________________________________;
③Z在一定条件下可以聚合生成高分子化合物,写出化学方程式 。