高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O 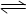 4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 |
制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:____ ________________。
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为____ ,正极反应为:____ 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L含有2.0×l0-4 mol·L-l K2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为____ mol。
下图中
~
均代表无机物或其水溶液,其中
、
、
是单质,
是地壳中含量最高的金属元素,
是气体,
是磁性材料。
根据图示回答问题:
(1)写出下列物质的化学式:
,E,I;
(2)反应①的化学方程式是;
反应②的化学方程式是;
(3)
与盐酸反应的化学方程式是;
反应后的溶液与
反应的化学方程式是。
1
水蒸汽和炽热的焦炭反应生成水煤气,反应吸热131.4
·
。利用该反应生成的氢气和空气中的氮气合成氨,其反应的
<0。氨可以用于制备硝酸。请回答:
(1)生成水煤气的热化学方程式是;
(2)合成氨需要在较大的压力下进行的原因是;
(3)温度过高或过低对合成氨的影响是;
(4)由氨生成
的各步反应的化学方程式是;
(5)某化肥厂由
制备
,进而生产硝铵(NH4NO3)。假设由氨氧化生成
的总产率是85%,而
和
完全反应生成
。列式计算:
①从
制取
过程中,用于中和硝酸所需的氨占总的氨消耗量的分数;
②若氨的消耗总量为100
,可生产
的量。
[ 化学──选修化学与技术]
分析下面两个案例并回答有关问题。
(1)某城镇生产、生活的分布情况如图所示,河流中
、
、
、
处某次水样抽测结果如表所示。
| 地点 项目 |
||||
| 水温/℃ |
15 |
18 |
26 |
25 |
| 6 |
8 |
5 |
5 |
|
| 溶解氧量/(
) |
11 |
9 |
7 |
3 |
①导致
、
处水样
变化的原因可能是;
②
处鱼类大量减少,产生这种现象的原因可能是。
(2)某地区已探明蕴藏有丰富的赤铁矿(主要成分为
,还含有
等杂质)、煤矿、石灰石和黏土。拟在该地区建设大型炼铁厂。
①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系。据此确定上图中相应工厂的名称A、B、C、D;
②以赤铁矿为原料,写出高炉炼铁中得到生铁和产生炉渣的化学方程式;
③从"三废"利用、环境保护等角度考虑,该地区和企业在生产中应采取的一些措施有(举出2种措施即可)。
②高炉炼铁相关反应:
 、
、
 ↑;
↑;
③从"三废"利用、环境保护等角度考虑,该地区和企业在生产中应建立污水处理系统,将石灰石煅烧成生石灰用于吸收发电厂和焦化厂燃煤时产生的SO2,减少对空气的污染。
均为有机化合物,请根据下列图示回答问题。
(1)直链有机化合物
的结构简式是;
(2)①的反应试剂和反应条件是;
(3)③的反应类型是;
(4)
的化学方程式是;
或
生成
的化学方程式是;
(5)
可应用于医疗、爆破等,由
的化学方程式是。
某些高分子催化剂可用于有机合成。下面是一种高分子催化剂(Ⅶ)合成路线的一部分(Ⅲ和Ⅵ都是Ⅶ的单体;反应均在一定条件下进行;化合物Ⅰ-Ⅲ和Ⅶ中含N杂环的性质类似于苯环): 回答下列问题:
回答下列问题:
(1)写出由化合物Ⅰ合成化合物Ⅱ的反应方程式(不要求标出反应条件)。
(2)下列关于化合物Ⅰ、Ⅱ和Ⅲ的说法中,正确的是(填字母)。
A.化合物Ⅰ可以发生氧化反应
B.化合物Ⅰ与金属钠反应不生成氢气
C.化合物Ⅱ可以发生水解反应
D.化合物Ⅲ不可以使溴的四氯化碳深液褪色
E.化合物Ⅲ属于烯烃类化合物
(3)化合物Ⅵ是(填字母)类化合物。
A.醇 B.烷烃 C.烯烃 D.酸 E.酯
(4)写出2种可鉴别V和M的化学试剂。
(5)在上述合成路线中,化合物Ⅳ和V在催化剂的作用下与氧气反应生成Ⅵ和水,写出反应方程式(不要求标出反应条件)。