工业上研究燃料脱硫的过程中,涉及如下反应:
CaSO4(s)+CO(g)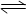 CaO(s)+SO2(g)+CO2(g),K1,△H1=" 218.4" kJ·mol-l(反应I)
CaO(s)+SO2(g)+CO2(g),K1,△H1=" 218.4" kJ·mol-l(反应I) CaSO4(s)+2CO(g)
CaSO4(s)+2CO(g)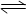
 CaS(s)+2CO2(g),K2,△H2=" -87.8" kJ·mol-l(反应II)
CaS(s)+2CO2(g),K2,△H2=" -87.8" kJ·mol-l(反应II)
(1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H= ;平衡常数K=____ (用K1,K2表示)。
CaS(s)+3CO2(g)的△H= ;平衡常数K=____ (用K1,K2表示)。
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
前100 s 内v(SO2)= mo1·L-1·s-l,平衡时CO的转化率为 。
(3)若只研究反应II,在不同条件下其反应能量变化如下图所示:图中曲线a到曲线b的措施是________,恒温恒容时,下列说法能说明反应Ⅱ到达平衡状态的是____ 。
| A.体系中气体的平均摩尔质量不再改变 |
| B.v(CO)=v(CO2) |
| C.CO的转化率达到了最大限度 |
| D.体系内气体压强不再发生变化 |
(4)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量[用n(CO)表示]对CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是
____ 。
②图像中T2 T1(填“高于”、“低于”、“等于”或“无法确定”):判断的
理由是____ 。
最近我国自主研制了一种新型燃料电池,一个电极通入空气,另一个电极通入汽油蒸气(以C4H10代表汽油),电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答如下问题:
(1)C4H10有正丁烷、异丁烷两种结构,写出异丁烷的一氯取代物的结构简式
(2)这个燃料电池放电时发生反应的化学方程式是
(3)这个电池的正极发生的反应是O2+4e-=2O2-,负极发生的电极反应方程式是
(4)固体电解质里O2-向 极移动,向外电路释放电子的是____________极。
下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素。
| 元素 |
相关信息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料。 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障。 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂。 |
| D |
室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰。 |
| E |
它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等。 |
根据上述信息填空:
(1)B在元素周期表中的位置是
(2)D的单质与烧碱水溶液加热时发生自身的氧化还原反应生成两种具有强还原性的阴离子,写出该反应的离子方程式
(3)C与A形成的化合物X,分子中原子个数比为1∶2;相同条件时,相同质量时,氢气的体积为X气体体积的16倍;分子中有极性键和非极性键,可作火箭燃料。写出X分子的结构式
(4)以上这五种元素能组成一种工业上用途极广的复盐(类似明矾,含一种阴离子和两种阳离子),该物质中的A、B、C、D、E的质量比为5∶56∶7∶16∶14。请写出该化合物的化学式________
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物之间可以反应生盐和水,该反应的离子方程式为__________________________
(2)W与Y可形成化合物W2Y,该化合物的电子式为_________。
(3)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):_________>_________>_________>_________。
(4)Z的最高价氧化物与水反应得到一种稀溶液,写出该反应的离子方程式_________________________
原子序数之和为16的三种短周期元素的单质X、Y、
Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化。已知B分子组成中Z原子个数比C分子中少一个。请回答下列问题: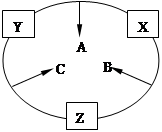
(1)元素X的原子结构示意图
(2)C与X在一定条件下生成化合物A的化学方程式
(3)常温下,C的水溶液能够使红色石蕊试纸变蓝,请用离子方程式表示变蓝的原因
(4)写出A与C反应生成Y和B的化学方程式
(5)加热条件下,C通过装有含X的黑色粉末的硬质玻璃管,黑色粉末变成紫红色,该黑色粉末的化学式 ;发生反应化学方程式为 。
在25 ℃,101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。若剩余气体的体积是15 L,则原CO和H2的混合气体中V(CO)=________L,V(H2)=________L。若剩余气体的体积为a L。则原CO和H2的混合气体中V(CO)∶V(H2)=________。若剩余气体的体积为a L,则a的取值范围是 。