某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。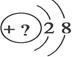
(1)该微粒是中性微粒,这种微粒的元素符号是____________;
(2)该微粒的符号为X3-,则这种微粒的单质的电子式为___________;
(3)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,该单质与水反应的化学方程式___________________________________;
(4)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,该单质与水反应的离子方程式:________________________________;
(5)该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式:__________;
(6)该微粒的符号为X3+,其氢氧化物与强碱反应的离子方程式:______________________.
(1)常温时,将浓度为m mol· L-1的CH3COOH溶液和n mol·L-1NaOH溶液等体积混合,混合后溶液的pH=7,m与n的大小关系是mn(填“>”、“<”或“=”,下同);若将PH=2的CH3COOH溶液和PH=12的NaOH溶液等体积混合,混合溶液的PH7
(2)消防用的泡沫灭火器内装的药品是硫酸铝溶液和碳酸氢钠溶液,用离子方程式表示二者混合时发生的反应
(3)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V1和碱溶液体积V2的关系为
(4)常温时KSP[Cu(OH)2]= 2.2×10-20,将Cu(OH)2溶于2.2mol/LCuCl2溶液中形成平衡,溶解平衡方程式为,溶液的PH为
(5)物质的量浓度相同的下列溶液①(NH4)2CO3 ②(NH4)2SO4 ③NH4HCO3④NH4HSO4⑤NH4Cl
⑥NH3·H2O。c(NH4+)由小到大的排列顺序是(填序号)
如图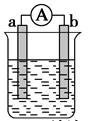 是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(1)当电极a为Al、电极b为Mg、电解质溶液为稀硫酸时,正极的电极反应式为____________;负极的电极反应式为____________。
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置__________(填“能”或“不能”)形成原电池。若不能,请说明理由;若能,请说明在两电极上所发生的现象:________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,氢氧化钠溶液为电解质溶液。则氢气应通入________(填“a”或“b”)极,正极上的电极反应式为___________。
(I)保护环境已成为当前和未来的一项全球性课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示: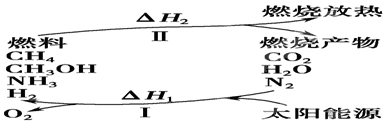
请回答下列问题:
(1)过程Ⅰ的能量转化形式为________能转化为________能。
(2)上述转化过程中,ΔH1和ΔH2的关系是________。
(3)断裂1 mol化学键所需的能量见下表:
| 共价键 |
H—N |
H—O |
N≡N |
O=O |
| 断裂1 mol化学键所需能量/(kJ·mol-1) |
393 |
460 |
941 |
499 |
常温下,N2与H2O反应生成NH3的热化学方程式为_______________________。
(II)在一试管中加入0.01mol/L的KMnO4酸性溶液和0.1mol/LH2C2O4溶液,在恒温下发生如下反应:
2KMnO4+5 H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2+8H2O。5分钟后测得Mn2+的浓度为0.004mol/L;
(4)试计算0—5分钟内,υ(H2C2O4)=____________。
(5)如果反应从开始进行一段时间后,速率—时间图像如图: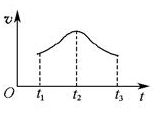 。试解释t1—t2,t2—t3速率变化的原因。______________________________________________________。
。试解释t1—t2,t2—t3速率变化的原因。______________________________________________________。
取100mL FeCl3、AlCl3的混合溶液,逐滴加入物质的量浓度为1 mol·L-1的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积(单位为mL)关系如下图所示。
按要求回答:
(1)a点对应沉淀的物质的量是mol;此时溶液中的溶质是。
(2)b点对应沉淀的物质的量是mol;原溶液中c(AlCl3)=mol·L-1。
混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化,据此回答有关问题:
(1)I、II、III、IV中溶液和沉淀分离采取的实验操作需要用到的玻璃仪器是、 、 。 固体B的化学式为。
(2)按要求写出上述过程①、②、③中发生的主要反应的离子方程式
①。
②。
③。