A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
| 元素 |
原子结构或性质 |
| A |
原子最外层电子数是内层电子总数的1/5 |
| B |
形成化合物种类最多的元素,其单质为固体 |
| C |
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D |
地壳中含量最多的元素 |
| E |
与D同主族 |
| F |
与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:(用对应的化学用语回答)
(1)B在元素周期表中的位置是__________;用电子式表示A和E形成的化合物的形成过程 。
(2)A、 D 、E、 F离子半径由大到小的顺序为________________________________。
(3)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是__________________;
(4)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是____________________。该反应为 反应。(填“吸热”或“放热”)
(5)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式为 。
(6)如图:将A和F的单质与烧碱液构成原电池,负极的电极反应式为 ;外电路中电子从 电极流向 电极 。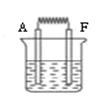
原子序数小于36的X、Y、Z、W四种元素,其X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题: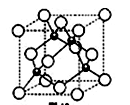
1)Y2X2分子中Y原子轨道的杂化类型为,1mol Y2X2含有σ键的数目为。
2)化合物ZX3的沸点比化合物YX4的高,其主要原因是。
3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是。
4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为。
氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示: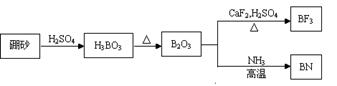
请回答下列问题:
1)由B2O3制备BF3、BN的化学方程式依次是、;
2)基态B原子的电子排布式为;B和N相比,电负性较大的是,BN中B元素的化合价为;
3)在BF3分子中,F-B-F的键角是,B原子的杂化轨道类型为,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为;
4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为,层间作用力为;
5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有个氮原子、个硼原子,立方氮化硼的密度是g/cm3(只要求列算式,不必计算出数值。阿伏伽德罗常数为NA)。
下表为长式周期表的一部分,其中的编号代表对应的元素。
根据上述表格中的十种元素填空:
1)表中属于ds区的元素是(填编号)。
2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨。有关该化合物分子的说法正确的是。
| A.分子中含极性共价键 | B.含有1个σ键和2个π键 |
| C.属于非极性分子 | D.该化合物分子中,②原子采用sp2杂化 |
3)金属性最强的主族元素是(填元素名称)。
4)⑤、⑥、⑦的离子半径由小到大的顺序是(填化学式)。
5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的未成对电子数为个; 该元素与元素①形成的分子X的空间构型为。
下图为一个金属铜的晶胞,请完成以下各题。
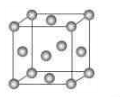
1)该晶胞“实际”拥有的铜原子数是个。
2)该晶胞称为。
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞
3)此晶胞立方体的边长为a cm,Cu的相对原子质量为64。阿伏加德罗常数为NA 。金属铜的晶体密度ρ为g/cm3。(用a、NA表示)。
4)铜原子采取的这种堆积方式的空间利用率为。(填数值)
A、B、C、D、E代表5种元素。请填空:
1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其原子核外电子的运动状态有种。
2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,
B原子的价电子排布图为,C元素的原子结构示意图为。
3)D元素的正三价离子的3d亚层为半充满,D的元素符号为,其基态原子的价电子排布式为。
4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为,其基态原子的电子排布式为。