(7分)黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg·kgˉ1。黄血盐易溶于水,在水溶液中会电离出K+和[Fe(CN)6]4ˉ,其中CNˉ的电子式为 。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
(1)上述反应是否为氧化还原反应?______ (填“是”或“不是”)。
(2)食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过4000C时会分解,试配平该反应的化学方程式:
(3) 黄血盐可与高锰酸钾溶液反应,其化学方程式为
K4Fe(CN)6+ KMnO4+ H2SO4→KHSO4+ F e2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
e2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
①该反应的氧化产物有___ ___(填化学式 )。
)。
②若有1mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为____ __mol。
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
⑥ |
⑦ |
||||||
| 三 |
① |
③ |
⑤ |
⑧ |
⑩ |
|||
| 四 |
② |
④ |
⑨ |
(1) ⑧⑨三种元素形成的气态氢化物最稳定的是___________________________。
(2) 写出①的最高价氧化物对应的水化物的电子式________。
(3) ②③④中形成的简单离子半径由大到小的顺序是________________________。
(4) 用电子式表示元素⑦的氢化物的形成过程________,该氢化物与元素⑧的单质反应的离子方程式是______________________________。
(5) ①和⑨两元素形成化合物的化学式为_________________________,该化合物的溶液与元素⑧的单质反应的离子方程式为___________________。
在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂
夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极。在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电。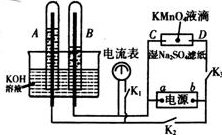
(1)写出B中电极反应式__________。
(2)在湿的硫酸钠溶液滤纸条中部的高锰酸钾液滴处发生的现象是______________。
(3)电解一段时间后,A、B中均有气体包围电极,此时切断K2、K3,闭合K1,则电流表的指针________(填。是”或。否”)移动,其理由是_______________________。
(4)在298K,若2g B 气体和0.5mol的A 气体完全反应,生成物为液态,放出
285・8kJ热量,写出此反应的热化学方程式:__________________________________。
在一定温度下,将2molA和2molB两种气体混合放入体积为2L的密闭刚性容器中,发生如下反应: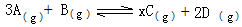
2min末反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol•L-1请回答:
(1)x的值为_______(2)A的转化率为________
(3)此温度下该反应的平衡常数K=
(4)若在同样的条件下,开始时加入C 、 D 各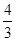 mol,要使平衡时各物质的百分含量与上述平衡相同,则还要加入______mol______ 物质.
mol,要使平衡时各物质的百分含量与上述平衡相同,则还要加入______mol______ 物质.
(5)保持温度不变,往同一容器中通入A、B、C、D各1mol,该反应向方向移动。
将足量AgCl分别放入:①5ml水②10ml 0.2mol·L-1 MgCl2溶液③20ml 0.5mol·L-1 NaCl溶液,④40ml 0.1mol·L-1盐酸中溶解溶解至溶液饱和,各溶液中Ag+的浓度分别为a、b、c、d,它们由大到小的排列顺序是_____________________;0.2mol·L-1 NH4Cl溶液中离子浓度大小关系是_______________。
写出符合要求的离子方程式:
(1)漂白粉与洁厕剂等强酸性物质混合使用会生成一种有毒气体_____________。
(2)泡沫灭火器的反应原理:___________ ________________________________。