(9分) 铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下: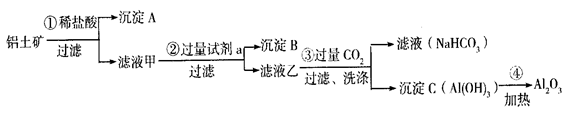
① 沉淀  A、B的成分分别是 、 ;步骤② 中的试剂a是 ;
A、B的成分分别是 、 ;步骤② 中的试剂a是 ;
② 试写出步骤③中发生反应的离子方式 __________ 、
__________ __________ ;
③简述检验所得滤液甲 中存在Fe3+的操作方法:__________ _。
中存在Fe3+的操作方法:__________ _。
(8分)在实验室里,某同学取一小块金属钠做与水反应的实验。试完成下列问题:
(1) 切开的金属钠暴 露在空气中,最先观察到的现象是
露在空气中,最先观察到的现象是
,所发生反应的化学方程式是 。
。
(2) 将钠投入水中后,钠融化成一个小球,根据这一现象你能得出的结论是:
①,②。将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是(填编号)。
| A.有气体生成 |
| B.钠融化成小球并在液面上游动 |
| C.溶液底部有银白色的金属钙生成 |
| D.溶液变浑浊 |
(3) 在钠与水反应过程中,若生成标准状况下224mL的H2,则转移的电子的物质的量为。
(4) 根据上述实验过程中钠所发生的有关变化,试说明将金属钠保存在煤油中的目的是。
(6分)(1)0.5 mol H2O的质量为_______________,其中含有_______________个水分子,共有_______________个原子。
(2)质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是_______________;在相同温度和相同压强条件下,体积最大的是_______________,体积最小的是_______________。
(10分)已知:A、F为金属单质,D、E为 气态单质,其余均为化合物,其中C的焰色反应呈黄色;B为黑色粉末,J为蓝色沉淀。各物质间的转化关系如右图所示(部分生成物已略去):
气态单质,其余均为化合物,其中C的焰色反应呈黄色;B为黑色粉末,J为蓝色沉淀。各物质间的转化关系如右图所示(部分生成物已略去):
(1)A的原子结构示意图为 _____________________,B的化学式为_______ __________。
__________。
(2)写出反应C+I→J的离子方程式:___________________________________________。
(3)写出E+F→I的化学反应方程式为___________________________,D在E中点燃时的现象为________________________________________________________。
在反应2KMnO4+16HCl==2KCl+2MnCl2+5Cl2+8H2O中:
氧化剂是氧化产物是氧化产物与还原产物的物质的量之比为
被氧化与未被氧化的HCl的质量之比为,若有73克HCl被氧化,电子转移的总数为,标准状况下生成Cl2的体积为L.用单线桥标出电子转移的方向和数目
(共12分)下图中A、B、C、D、E、F、G均为有机化合物。
根据上图回答问题:
⑴ D的化学名称是_____________。
⑵ 反应③的化学方程式是________________________________________________。
(有机物须用结构简式表示)
⑶ B的分子式是_____________。A的结构简式是_________________________。反应①的反应类型是___________。
⑷ 符合下列3个条件的B的同分异构体的数目有______个。
i)含有邻二取代苯环结构、ii)与B有相同官能团、iii)不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式___________________________。
⑸ G是重要的工业原料,用化学方程式表示G的一种重要的工业用途______________。