重金属离子对河流及海洋造成严重污染。某化工厂废水(pH=2.0,ρ≈1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 |
AgI |
AgOH |
Ag2S |
PbI2 |
Pb(OH)2 |
PbS |
| KSP |
|
5.6×10-8 |
6.3×10-50 |
7.1×10-9 |
1.2×10-15 |
3.4×10-28 |
(1)你认为往废水中投入 (填字母序号),沉淀效果最好。
| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= 。
(3)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%。若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag+)= ,是否符合排放标准 (填“是”或“否”)。已知KSP(AgCl)=1.8×10-10mol2·L-2。
乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2 g金属钠充分反应,则标准状况下生成气体的体积是 L。
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8 g,碱石灰增重13.2 g。则氧气的物质的量是 mol,燃烧产物的平均摩尔质量是 g/mol。
在①CH2=CH2②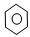 ③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
(1)属于高分子化合物的是 ;(请填物质的序号,下同。);
(2)能使Br2的CCl4溶液褪色的是 ;
(3)既能发生取代反应又能发生加成反应的是 ;
(4)能与Na2CO3溶液反应的是 ;
(5)能发生酯化反应的是 ;
现有A、B、C三种烃,其球棍模型如下图: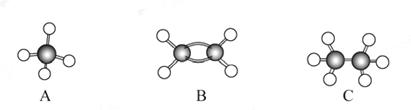
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是_____(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是_____;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____,生成水最多的是_____。
(4)在120 ℃、1.01×105Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是_____。
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。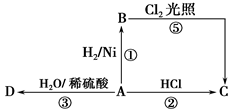
据图回答下列问题:
(1)写出A、C、D的结构简式:A________, C________, D________。
(2)写出①②两步反应的化学方程式,并注明反应类型:
①________________________________________________反应类型为____________。
②_______________________________________________
下列物质中互为同分异构体的有 ,互为同素异形体的有 ,属于同位素的有 ,属于同一种物质的有 。(填序号)
①液氯 ②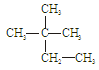 ③白磷 ④18O ⑤
③白磷 ④18O ⑤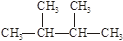
⑥红磷⑦16O⑧氯气