(物质结构与性质)有A、B、C、D、E、F 6种元素,B原子得到一个电子后3p轨道全充满,A+比B形成的简单离子少一个电子层;C原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的;D和E是位于同一主族的短周期元素,E元素的最高化合价和最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%;F元素的核电荷数为26。请回答下列问题:
(1)A元素位于元素周期表中第_________周期第__________族;;F元素基态原子形成的+3价阳离子的电子排布式为___________。
(2)C与B形成的CB3分子中C原子的杂化方式是____________,其分子的空间构型是____________
(3)另一元素X与A同主族,第一电离能小于A,晶体XB与AB中熔点较高的是 _____________,其理由是______________________
(4)1mol ED晶体中含有的E—D键的数目是____________。
氢化阿托醛 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下:
(1)在合成路线上②、③的反应类型分别为
②③ 。
(2)由 反应的化学方程式为。
反应的化学方程式为。
(3)1mol氢化阿托醛发生银镜反应最多可生成molAg。
(4)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为。D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有种。
(4分)现有四种试剂:
| A.新制Cu(OH)2悬浊液; | B.浓硝酸; | C.AgNO3溶液; | D.碘水。为了鉴别下列四瓶无色溶液,(其他实验条件略)请你选择合适的试剂,将其填入相应的括号中。 |
(1)葡萄糖溶液()(2)食盐溶液()
(3)淀粉溶液()(4)鸡蛋清溶液()
(10分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生。
第二份加足量NaOH溶液加热后,收集到0.08 mol气体。
第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g.。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl-
(2)由第二份进行的实验得知混合物中应含有离子,其物质的量浓度为
(3)由第三份进行的实验可知12.54g沉淀的成分为
请计算形成该沉淀的原混合物中各离子的物质的量。(要求写出计算过程)
(4)综合上述实验,你认为以下结论正确的是
| A.该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl-,且n(K+)≥0.04mol |
| B.该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl- |
| C.该混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl- |
| D.该混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl- |
已知有以下物质相互转化。试回答: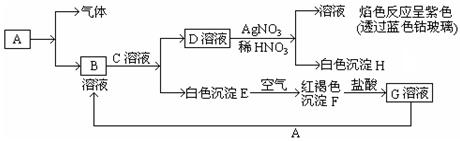
(1)写出B的化学式,D的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出向G溶液加入A的有关离子反应方程式。
利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)写出化学方程式,并注明反应类型:
①B与醋酸反应:_____________________________________,_________________反应。
②B→C:___________________________________________,_________________反应。
(2)可用于检验A的试剂是_________________________________________。