根据下列反应判断有关物质还原性由强到弱的顺序是( )
H2SO3+I2+H2O=2HI+H2SO4 2FeCl3+2HI=2FeCl2+2HCl+I2
3 FeCl2+4H2NO3=2FeCl2+NO+2H2O+Fe(NO3)2
| A.H2SO3> I—>Fe2+>NO | B.I—>Fe2+>H2SO3>NO |
| C.Fe2+>I—>H2SO3>NO | D.NO>Fe2+>H2SO3>I— |
对于可逆反应:2A(g)+B(g) 2C(g);△H<0,下列各图中正确的是()
2C(g);△H<0,下列各图中正确的是()
以NA代表阿伏加德罗常数,关于热化学方程式CH4(g) + 2O2 = CO2(g) + 2H2O(l)△H=—890 kJ/mol,下列说法中正确的是()
A.有4NA个电子转移时,放出890 kJ的能量
B.有NA个C—H共价键断裂时,放出890 kJ的能量
C.有2NA个水分子生成且水为液体时,放出890 kJ的能量
D.有NA个C、O间的共用电子对生成时,放出890 kJ的能量
a mol N2与b mol H2混合,要一定条件下反应达到平衡,生成了c mol NH3,则NH3在平衡体系中质量分数为()
A.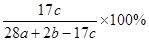 |
B.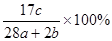 |
C. |
D.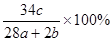 |
某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A + 3B  2C,若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中C气体的体积占10%,下列推断正确的是()
2C,若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中C气体的体积占10%,下列推断正确的是()
①原混合气体的体积为1.2VL②原混合气体的体积为1.1VL
③反应达平衡时,气体A消耗掉0.05VL④反应达平衡时,气体B消耗掉0.05V L
| A.②③ | B.②④ | C.①③ | D.①④ |
可逆反应:3A(g) 3B(?) + C(?),正反应为吸热反应,随着温度的升高,气体的平均相对分子质量有变小的趋势,则下列判断正确的是()
3B(?) + C(?),正反应为吸热反应,随着温度的升高,气体的平均相对分子质量有变小的趋势,则下列判断正确的是()
| A.B和C可能都是固体 | B.B和C一定是气体 |
| C.若C为固体,则B一定是气体 | D.B和C不可能都是气体 |