某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去)。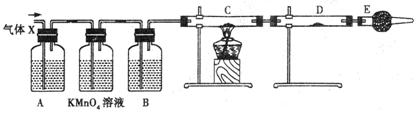
试回答:
(1)上述实验中生成二氧化硫的反应的化学方程式为:
(2)乙同学认为还可能产生氢气的理由:
。
(3)丙同学在安装好装置后,必不可少的一步操作是: 。
(4)A中加入的试剂可能是____________,作用是_ ;
B中加入的试剂可能是____________,作用是 ;
E中加入的试剂可能是____________,作用是 。
(5)可以证明气体X中含有氢气的实验现象是:
C中: ,D中: ;
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?____________
(填“能”或“不能”);其原因是: 。
阿司匹林的有效成分是乙酰水杨酸( )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
操作流程如下:
已知:水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,醋酸酐遇水分解生成醋酸。
回答下列问题:
(1)合成过程中最合适的加热方法是。
(2)制备过程中,水杨酸会形成聚合物的副产物。写出该聚合物的结构简式。
(3)粗产品提纯:
① 分批用少量饱和NaHCO3溶解粗产品,目的是。判断该过程结束的方法是。
② 滤液缓慢加入浓盐酸中,看到的现象是。
③ 检验最终产品中是否含有水杨酸的化学方法是。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品m g;Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2mL。
① 写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式
。
② 阿司匹林药片中乙酰水杨酸质量分数的表达式为。
氧化亚铜是大型水面舰船防护涂层的重要原料。某小组进行如下研究,请填写下列空白。
实验1:氧化亚铜的制取氧化亚铜可用葡萄糖和新制氢氧化铜悬浊液反应制取。文献表明,条件控制不当时会有少量CuO生成。
(1)实验室制取氢氧化铜悬浊液的离子方程式为____________。
(2)实验室用此方法制取并获得少量氧化亚铜固体,需要的玻璃仪器有试管、酒精灯、烧杯____________和____________。
(3)若要探究该反应发生的最低温度,应选用的加热方式为____________。
实验2:测定氧化亚铜的纯度
方案1:称取实验1所得固体m g,采用如下装置进行实验。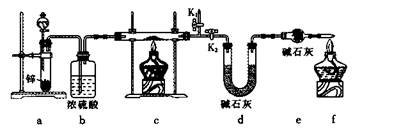
(4)装置a中所加的酸是____________(填化学式)。
(5)通过测出下列物理量,能达到实验目的的是____________。
| A.反应前后装置a的质量 |
| B.装置c充分反应后所得固体的质量 |
| C.反应前后装置d的质量 |
| D.反应前后装置e的质量 |
(6)在氢气验纯后,点燃装置c中酒精灯之前需要对K1、K2进行的操作是____________
方案2:将实验l所得固体mg溶于足量稀硫酸,经过滤、洗涤、干燥后称出不溶物的质量(资料:Cu2O+2H+=Cu2++Cu+H2O)
(7)判断经干燥器干燥后的不溶物是否巳完全干燥的操作方法是__________________________________。
(8)若实验所得不溶物为ng,则该样品中氧化亚铜的质量分数为________________。
保护环境是全球关注的问题。
Ⅰ.某环保部门处理含CN-电镀废水的方法如图(CN-的CNO-中的N的化合价均为-3价):
某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究。
操作步骤:
i.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200mL混合液(其中c(CN-)为0.200mol·L-1)加到装置甲中,塞上橡皮塞。
ii.装置甲中,充分反应后,打开橡皮塞和开关,使溶液全部流入装置乙中,关闭开关。
iii.测定干燥管I增加的质量。
(1)写出装置乙中反应的离子方程式:。
(2)装置丙中的试剂是,装置丁的作用是。
(3)假定上述实验中的气体都被充分吸收。若干燥管I增重1.408g。则CN-被处理的百分率为。
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将(填“偏高”、“偏低”、“无法确定”或“无影响”)。简述你的理由:。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)科学研究表明,脱硫率与Fe3+浓度、pH关系如图1、2。
为达到最佳脱硫效果,应采取的适合[Fe3+]及pH分别是、。
(6)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液后,各取10mL反应液分别加到编号为A、B、C的试管中,并设计后续实验的3个方案:
方案①:A中加入少量KMnO4溶液,紫红色褪去。
方案②:B中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是。
实验室以空气(O2体积分数20%)为原料,在无碳、无水的环境下,用下图A装置制备臭氧(3O2 2O3)。
2O3)。
(1)空气通入A装置之前,应先后通过上述装置中的、(填装置序号)。
(2)臭氧与碘化钾溶液反应为:2KI+O3+H2O=2KOH+I2+O2。将a处气体通入装置B,溶液中的现象为。
(3)为测定O2转化为O3的转化率,将装置B中的溶液全部转入另一容器中,加入CC14,经萃取、分液、蒸馏、冷却、称重,得I2固体0.254g。
①萃取操作所用玻璃仪器的名称。
②若实验时通入空气1.12L(标准状况),O2的转化率为。
③测定时需在A、B装置间连接装置D,原因是。
(4)工业上分离O3和O2,可将混合气体液化后再分离,下列分离方法合理的是(填序号)。
A.过滤 B.分馏 C.分液 D.萃取
(5)臭氧可用于含CN一碱性电镀废水的处理。第i步:CN一转化为OCN-;第ii步:OCN一继续转化为CO32一及两种单质气体。若第ii步转化时,O3与OCN-物质的质量之比为3∶2,该步反应的离子方程式为。
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______。
(2)装置a和c的作用分别是____和____(填标号)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。