反应4 NH3 + 5 O2 =" " 4 NO + 6 H2O在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol ,则此反应的平均速率V(X) (表示反应物的消耗速率或生成、物的生成速率)为
| A.V(O2)=0.01mol /(L·s) | B.V(NO)=0.008 mol /(L·s) |
C.V(H2O)=0.003 mol /(L·s) | D.V(NH3)=0.0025 mol /(L·s) |
对于可逆反应mA + nB  pC +qD从正反应开始反应并在一定条件下达到平衡后,如果增大压强,则容器内气体平均相对分子质量增大,下列有关判断错误的是
pC +qD从正反应开始反应并在一定条件下达到平衡后,如果增大压强,则容器内气体平均相对分子质量增大,下列有关判断错误的是
| A.反应物A或B至少有一个是气体 |
| B.容器内不可能是单一气体 |
| C.m+n可能大于p+q |
| D.若m<p,且D是气体,则B一定是气体 |
在相同的温度与体积下,对反应CO2(g) + H2(g)  CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 |
H2 |
CO |
H2O |
|
| 甲 |
amol |
amol |
0mol |
0mol |
| 乙 |
2amol |
2amol |
0mol |
0mol |
| 丙 |
2amol |
2amol |
amol |
amol |
| 丁 |
amol |
0mol |
2amol |
2amol |
上述四种情况,起始的时候正反应速率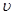 (H2)正大小顺序正确的是
(H2)正大小顺序正确的是
A.丙>丁>乙>甲 B.丙>乙=丁>甲C.丙>乙>甲>丁D.乙=丙>甲>丁
下列关于可逆反应H2(g) + I2(g)  2HI(g)在一定温度与体积条件下达到平衡的判断正确的是
2HI(g)在一定温度与体积条件下达到平衡的判断正确的是
| A.每断裂1mol H-H键的同时断裂1mol I-I键 |
| B.每断裂1mol I-I键的同时生成2mol H-I键 |
| C.每消耗1molH2的同时消耗2molHI |
| D.压强不发生改变 |
对于平衡CO2(g)  CO2(aq) △H <0,为增大CO2在水中的溶解度,应采用的方法是
CO2(aq) △H <0,为增大CO2在水中的溶解度,应采用的方法是
| A.增加压强 | B.升高温度 | C.不断搅拌 | D.升温减压 |
下列关于反应N2 + 3H2 2NH3的反应速率说法一定正确的是
2NH3的反应速率说法一定正确的是
| A.每消耗1molN2的同时消耗2molNH3 |
| B.相同时间内消耗28gN2与消耗6gH2的反应速率相同 |
C.当 (N2)=3 (N2)=3 (H2)时表示反应已达平衡 (H2)时表示反应已达平衡 |
D.2min内H2减少3mol,则 (N2)=0.5mol/(L·min) (N2)=0.5mol/(L·min) |