若甲烷与氯气以物质的量之比1:3混合,在光照下得到的产物:⑴CH3Cl,⑵CH2Cl2,⑶CHCl3,⑷CCl4,其中正确的是 ( )
| A.只有⑴ | B.只有⑶ |
| C.⑴⑵⑶的混合物 | D.⑴⑵⑶⑷的混合物 |
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图)。下列说法正确的是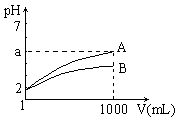
①a=5时,A是强酸,B是弱酸
②若A、B都是弱酸,则 5>a>2
③稀释后,A酸溶液的酸性比B酸溶液的酸性强
④A、B两种酸溶液的物质的量浓度一定相等
A.①② B.③④ C.①③ D.②④
某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7。下表中判断合理的是
| 编号 |
HX |
YOH |
溶液的体积关系 |
| ① |
强酸 |
强碱 |
V(HX)=V(YOH) |
| ② |
强酸 |
强碱 |
V(HX)<V(YOH) |
| ③ |
强酸 |
弱碱 |
V(HX)=V(YOH) |
| ④ |
弱酸 |
强碱 |
V(HX)=V(YOH) |
A.①③ B.②③ C.①④ D.②④
工业上用CO生产甲醇的反应为CO(g)+2H2(g)  CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图。下列叙述错误的是
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图。下列叙述错误的是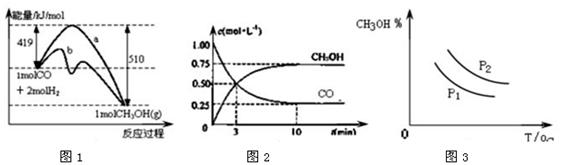
| A.CO和H2合成CH3OH的反应:△H <0,△S < 0 |
| B.保持温度不变,再充入1molCO和2molH2,反应达到新平衡时n(CH3OH)/n(CO)减小 |
| C.图1中曲线b可表示使用了催化剂的能量变化情况 |
| D.图3中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况 |
一定温度下,在容积固定的密闭容器中进行的可逆反应:2NO2 2NO+O2,达到平衡的标志是
2NO+O2,达到平衡的标志是
①相同时间内,氧气的生成速率为n mol·L-1·s-1,NO2的生成速率为2n mol·L-1·s-1
②单位时间内生成n mol O2的同时生成2n mol的NO
③混合气体的颜色不再变化
④混合气体的密度保持不变
⑤混合气体的平均相对分子质量不再改变
⑥压强不随时间变化而变化
| A.①③⑤⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤⑥ |
下图表示温度、压强对下列平衡的影响:N2 (g)+3H2(g)  2NH3(g) △H<0
2NH3(g) △H<0
图中y轴表示的意义是
| A.正反应速率 |
| B.平衡混合气体中NH3的含量 |
| C.平衡混合气体中N2的物质的量 |
| D.H2的转化率 |