己知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复: NH4+、Ba2+、 Na+、H+、SO42-、NO3-、OH-、CO32-,将这4种溶液分别标记为A、B、C、D进行如下实验:①在A或D中滴入C,均有沉淀生成;② D和B反应生成的气体能被A吸收;③ A和D反应生成的气体能被B吸收。试回答下列问题 :
(1) D的化学式是 , 判断理由
(2) 写出其余几种物质的化学式 : A B C
(3) 写出实验②中有关反应的离子方程式
A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电 子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式。
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为___________________________________;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)_______________。
(4)C2A4 ─ 空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:正极的电极反应式是__________ _________________________。
_________________________。
(5)已知:2CD2(g)  C2D4(g);△H<0。在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
C2D4(g);△H<0。在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。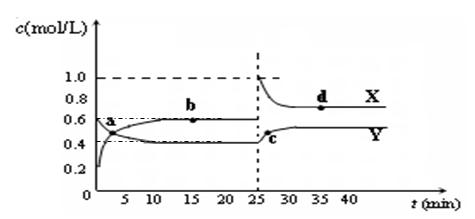
① a、b、c、d四个点中,化学反应处于平衡状态的是_ ______点。
______点。
② 25 min时,增加了_______(填物质的化学式)________mol。
③ a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是_______(填字母)。
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是。
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式; 。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是。
| A.Ag | B.Cu | C.Al | D.Fe |
(4)烧碱、纯碱均可吸收CO2,当含0.2 mol NaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:
①;②Na2CO3;③;④NaHCO3
将得到的固体重新溶解于水,在溶液中加过量的盐酸,使其充分反应后,再将溶液蒸干,得到固体的质量是g。
下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物.
试推断:
(1)写出物质的化学式:A:____________、C:____________、I:____________.
(2)写出下列反应的方程式:
C→F的离子方程式______________________________________________.
H→I的化学方程式________________________________________________.
(8分).某科研小组用高岭土(主要成分是Al2O3·2SiO2·2H2O,并含少量CaO、Fe2O3)研制新型净水剂(铝的化合物)。试验流程如下:
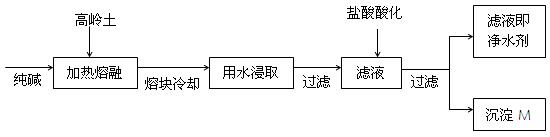
请回答下列问题:
(1)已知Al2O3、SiO2与纯碱的反应相似。用化学方程式表示熔融时高岭土主要成分与纯碱发生反应的化学方程式、
。
(2)在熔融高岭土与纯碱试样时,最好选用下列哪种仪器(填写编号)
| A.铁坩埚 | B.瓷坩埚 | C.氧化铝坩埚 | D.玻璃坩埚 |
(3)写出上述过程中,最后得到的沉淀M的化学式。
(8分)有X、Y、Z、W四种在中学学过的固体化合物,实验现象如下:
①X、Y、Z、W的焰色反应均为黄色。
②在Z、W中加入稀盐酸,均有无色、无气味的气体放出。
③Y、Z、W分别与适量的Ba(OH)2浓溶液反应,均有白色沉淀生成;再加入过量盐酸,由Z、W生成的白色沉淀均溶解,由Y生成的白色沉淀不溶解。
④在相同条件下,将足量的Y的溶液分别加到相同物质的量浓度、相同体积的Z和W的溶液中,都有气泡出现。其中W溶液中气泡出现较快。
⑤X与CO2反应生成Z,同时生成另一种气体,此气体由地壳中含量最多的元素组成。
根据上述现象,回答下列问题:
(1)X的化学式为,Y的化学式为;
(2)写出下列有关反应的化学方程式或离子方程式。
①Z+石灰水(离子方程式);
②X+ CO2(化学方程式);
③W (化学方程式)
(化学方程式)
 。
。