常温下某集气瓶中气体呈红棕色,加入适量水后,盖上瓶盖振荡,得到无色溶液,气体的红棕色消失,再打开瓶盖后,瓶中又呈红棕色,则原瓶中气体可能是
| A.NO2 | B.Br2 | C.NO | D.N2 |
二甲醚和乙醇是同分异构体,其鉴别可采用化学方法或物理方法,下列鉴别方法中不能对二者进行鉴别的是
| A.利用金属钠或者金属钾 | B.利用质谱法 |
| C.利用红外光谱法 | D.利用核磁共振氢谱 |
下列根据实验操作和现象所得出的结论正确的是
| 实验操作 |
现象 |
解释或结论 |
|
| A |
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 |
出现白色沉淀 |
溶液X中一定含有SO42- |
| B |
等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 |
HA放出的氢气多且反应速率快 |
HB酸性比HA强 |
| C |
在镁、铝为电极,氢氧化钠为电解质的原电池装置中 |
镁表面有气泡 |
金属活动性:Al>Mg |
| D |
向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后加入0.5 mL有机物Y加热 |
未出现砖红色沉淀 |
Y中不含有醛基 |
在学习中,我们经常应用类推法。下列左边正确,类推法应用于右边也正确的是
| A |
向FeCl2溶液中滴入氯水 2Fe2++ Cl2= 2Fe3++ 2Cl— |
向FeCl2溶液中滴入碘水 2Fe2++ I2= 2Fe3++2I— |
| B |
CO2通入漂白粉溶液中 CO2+ Ca2++2ClO—+H2O=CaCO3↓+ 2HClO |
SO2通入漂白粉溶液中 SO2 +Ca2++2ClO—+H2O=CaSO3↓+2HClO |
| C |
向Na2CO3溶液中滴入稀HNO3 CO32—+ 2H+ = CO2↑+ H2O |
向Na2SO3溶液中滴入稀HNO3 SO32— +2H+ = SO2↑+H2O |
| D |
向澄清石灰水中通入少量CO2气体 Ca2++2OH— +CO2= CaCO3↓+ H2O |
向澄清石灰水中通入少量SO2气体 Ca2++2OH— +SO2= CaSO3↓+H2O |
从下列实验事实所得出的相应结论不正确的是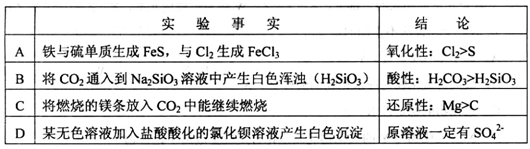
有BaCl2和NaCl的混合溶液2.0L,将它平均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl—离子完全沉淀。反应中消耗0.5mol H2SO4、2.0mol AgNO3。据此得知原混合溶液中的c(Na+)为
| A.0.5 mol·L-1 | B.0.75 mol·L-1 |
| C.1.5 mol·L-1 | D.1.0 mol·L-1 |