在一密闭容器中有CO、H2、O2共16.5g,用电火花引燃,使其完全燃烧,再将燃烧的气体用Na2O2充分吸收,Na2O2增重7.5g,则原混合气体中O2的质量分数是
| A.36% | B.54.5% | C.40% | D.33.3% |
能在水溶液中大量共存的一组离子是()
A.H+、NO3-、Fe2+、Na+、S O42- O42- |
B.Ag+、Fe3+、Cl―、SO42― |
| C.K+、SO42-、Cu2+、NO3― | D.NH4+、OH-、Cl-、HCO3- |
下列条件下,两瓶气体所含原子数一定相等的是()
| A.同质量、不同密度的N2和CO | B.同温度、同体积的H2和N2 |
| C.同压强、同体积的N2O和CO2 | D.同体积、不同质量的C2H4和C3H6 |
化学在日常生活和生产中有着重要的应用。下列说法不正确的是()
| A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B.纯二氧化硅大量用于制造光导纤维 |
| C.Al2O3的熔点很高,可用于制作耐高温材料 |
| D.电解MgCl2饱和溶液,可制得金属镁 |
高温下,某反应达平衡,平衡常数K=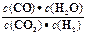 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.恒温恒容下,增大压强,H2浓度一定减小 | B.该反应的焓变为正值 |
| C.该反应化学方程式为CO+H2O=CO2+H2 | D.升高温度,逆反应速率减小 |
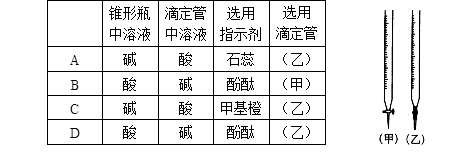
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考右图,从表中选出正确选项