Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x的值是
| A.2 | B.3 | C.4 | D.5 |
在体积均为1L,pH均等于2的盐酸和醋酸溶液,分别投入0.23g Na,则下图中比较符合反应事实的曲线是( )
氨水中有下列平衡NH3·H2O  NH4++OH- ,当其他条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是()
NH4++OH- ,当其他条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是()
| A.加NaOH 固体 | B.加浓HCl | C.加NH4Cl固体 | D.加同浓度的氨水 |
X、Y、Z是原子序数依次增大的同一短周期元素。X为金属元素,X的单质能与冷水发生剧烈反应;Y的最外层电子数是核外电子层数的2倍,X与Y可形成化合物X2Y;Z单质为共用一对电子对的双原子分子。下列说法不正确的是( )
| A.Y2—的还原性较Z—强 |
| B.Y的氢化物与X2Y所含化学键的类型相同 |
| C.YO2与Z2均可作为漂白剂,但起漂白作用的原理不同 |
| D.以石墨为电极电解XZ的水溶液,在阴极附近滴入酚酞可观察到溶液显红色 |
下列有关实验操作、现象或实验原理叙述错误的是()
| A.在中和热测定的实验中,将氢氧化钠和盐酸混合反应后的最高温度作为末温度 |
| B.纸层析法分离Fe3+和Cu2+ 的实验中,点样后的滤纸无需晾干就可将其浸入展开剂中 |
| C.将KNO3和NaCl的混合液加热并浓缩至有晶体析出时,趁热过滤可分离得NaCl晶体 |
| D.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,借此可判断锌镀层是否反应完全 |
下列各组物质中,不能满足“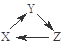 ”转化关系的一组是( )
”转化关系的一组是( )
| X |
Y |
Z |
|
| A |
Si |
SiO2 |
Na2SiO3 |
| B |
CO2 |
Na2CO3 |
NaHCO3 |
| C |
Al2O3 |
NaAlO2 |
Al(OH)3 |
| D |
Cu |
CuO |
CuSO4 |