已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化: MnO4-+C2O42-+H+→Mn2++CO2↑+H2O(未配平) MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液全部转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.0200mol·L-1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应。试回答下列问题:
⑴配平: MnO4-+ C2O42-+ H+― Mn2++ CO2↑+ H2O
⑵0.0200mol·L-1KMnO4标准溶液应置于 (选填“甲”或“乙”)滴定管中;判断滴定终点的依据是 ;
⑶你能否帮助该研究小组求得软锰矿中MnO2的质量分数 (选填“能”或“否”)。若回答“能”,请给出计算结果;若回答“否”,试说明原因 ;
⑷若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 。
| A.滴定前尖嘴部分有一气泡,滴定终点时消失; | B.溶液转移至容量瓶中,未将烧杯、玻棒洗涤; | C.滴定前仰视读数,滴定后俯视读数; | D.定容时,俯视刻度线;E.锥形瓶水洗之后未用待测液润洗。 |
在实验室我们将乙醇、浓硫酸、冰醋酸混合,利用下图所示的装置制取乙酸乙酯。回答下列问题: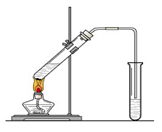
⑴浓硫酸的作用是:①②。
⑵饱和碳酸钠溶液的主要作用是。
⑶装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,其目的是 。
⑷若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
⑸做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
近年来特大地震灾害频繁发生,地震过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。工业上制漂白粉有以下工序:
(1)海水晒盐。
(2)粗盐提纯:粗盐中主要含有MgCl2、Na2SO4和FeCl3杂质,设计如下方案: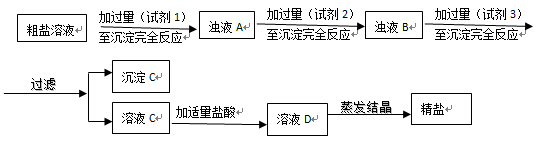
①试剂1~试剂3依次为:..。
②沉淀C含有BaSO4、Mg(OH)2还有(用化学式表示)。
(3)电解法制氯气:观察下图,回答: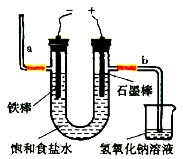
①通电后,(填a或b)侧产生氢气。
②此电解反应的化学方程式为。
(4)制取漂白粉:将氯气通入消石灰(Ca(OH)2)中反应,化学方程式为:。
(5)实验室加热MnO2和浓盐酸混合物来制取氯气。
①若有8.7克的MnO2被还原,则有molHCl被氧化。
②在下列各装置中,选用必要的装置,制备纯净干燥的Cl2,并按从左到右的顺序连接仪器,用接口字母按顺序连接为:。(顺序错误不得分)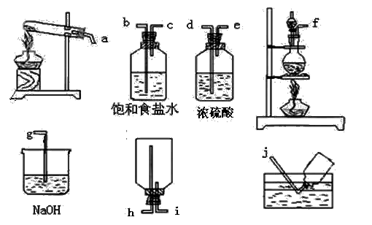
某学生需要用烧碱固体配制0.5 mol·L-1的NaOH溶液500mL。实验室提供以下仪器:①100mL烧杯②100 mL量筒③1000 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)。请回答下列问题:
(1)计算和称量:需要托盘天平称取NaOH固体g;
(2)实验中必须使用的仪器有_____(填代号),还缺少的仪器是、 。(填仪器名称)
(3)配制时,其正确的操作顺序是(字母表示,每个操作只用一次) ________;
| A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡 |
B.在盛有NaOH固体的烧杯中加入适量水 溶解 溶解 |
| C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中 |
| D.将容量瓶盖紧,反复上下颠倒,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1—2cm处
(4)实验两次用到玻璃棒,其作用分别是:先用于________.后用于________;
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是;(填下列编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤A④加蒸馏水时不慎超过了刻度线
(6)若实验过程中出现(5)中④这种情况你将如何处理?。
Ⅰ.对于混合物的分离或提纯,常采用的方法有:①过滤②蒸发结晶③蒸馏④萃取⑤洗气⑥加热分解等。请选用合适的方法序号完成下列填空。
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)除去H2中的CO2,可用的方法除去。
(3)为了从氯化钾和二氧化锰的混合物中获得氯化钾,可先加足量的水溶解,过滤,将得到的滤液
,就可得到氯化钾晶体。
(4)除去氧化钙中的碳酸钙,可用的方法。
(5)从溴水中提取溴单质,可用 方法。
方法。
(6)分离沸点相差较大的液体混合物,可用方法。
Ⅱ.下列仪器常用于物质分离的是__________________(填序号)
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥研钵
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,下图是制取并探究Cl2化学性质的装置图。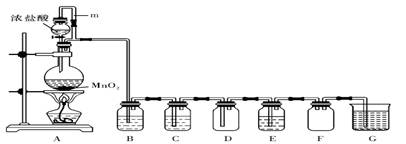
(1)圆底烧瓶中发生反应的化学方程式为 。
(2)A 中m 管的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是。
(4)E中若装有FeCl2 溶液,反应的离子方程式为;
E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,某中学高一化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2 中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是;
实验c的目的是。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是。