在下述条件下,一定能大量共存的离子组是
| A.c(HCO3-)=0.1mol/L的溶液中:Na+、K+、CO32-、Br- |
| B.pH=1的NaNO3水溶液中:NH4+、Fe2+、SO42-、Cl- |
| C.无色透明的水溶液中:K+、Mg2+、I-、MnO4- |
| D.由水电离产生的c(OH-)=1×10-14mol/L的溶液中: Al3+、Cl-、NO3- |
在固定体积的密闭容器中进行如下反应:2SO2(g) + O2(g) 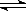 2 SO3(g)。已知反应过程某一时刻SO2,O2,SO3浓度(mol/L)分别为0.2,0.1,0.2,达到平衡时,浓度可能正确的是
2 SO3(g)。已知反应过程某一时刻SO2,O2,SO3浓度(mol/L)分别为0.2,0.1,0.2,达到平衡时,浓度可能正确的是
| A.SO2,O2分别为0.4,0.2mol/L | B.SO2为0.25mol/L |
| C.SO2,SO3均为0.15mol/L | D.SO3为0.4mol/L |
“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是
| A.蛋白质和脂肪 | B.蛋白质和高级烃 | C.淀粉和油脂 | D.纤维素和油脂 |
某气态烃在密闭容器内与氧气混合完全燃烧,如果燃烧前后容器内(温度高于100℃)压强保持不变,该烃可能是
| A.C2H6 | B.CH4 | C.C3H8 | D.C3H6 |
下列说法不正确的是
| A.在共价化合物中一定含有共价键 |
| B.含有离子键的化合物一定是离子化合物 |
| C.含有共价键的化合物一定是共价化合物 |
| D.化学反应过程中,反应物分子内的化学键断裂,产物分子的化合键形成 |
金属冶炼中不会涉及到的反应类型是
| A.氧化还原反应 | B.置换反应 | C.分解反应 | D.复分解反应 |