在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:
3A(g)+B(g)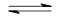 xC(g)+D(s),向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B和3 mol C和2 mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是
xC(g)+D(s),向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B和3 mol C和2 mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是
A.若平衡时,甲、乙两容器中A的物质的量不相等,则x=4
B.平衡时,甲、乙两容器中A、B的物质的量之比不相等
C.平衡时甲中A的体积分数为40%
D.若平衡时两容器中的压强不相等,则两容器中压强之比为8∶5
下图是氯碱工业中应用的立式隔膜电解槽示意图,其中的离子膜仅允许阳离子通过。下列说法正确的是
| A.B电极反应式:2Cl- - 2e → Cl2↑ |
| B.W是稀的氯化钠溶液 |
| C.Z是氢氧化钠溶液 |
| D.a是电源负极 |
下列离子方程式书写正确的是
| A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性 H+ + SO42- + Ba2+ + OHOHOHOH- → BaSO4↓+ H2O |
| B.将标准状况下112 mL氯气通入10 mL 1 mol·L-1的溴化亚铁溶液中 2Fe2+ + 4Br-+ 3Cl2 → 2Fe3+ + 6Cl- + 2Br2 |
| C.碳酸氢铵溶液中加入足量NaOH溶液 NH4++ HCO3-+2OH-→ CO32-+NH3·H2O+H2O |
| D.向澄清石灰水中加入过量的碳酸氢钠溶液 |
Ca2+ + 2OHOHOHOH- + 2HCO3-→ CaCO3↓ + 2H2O + CO32-
NaH是一种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是
| A.跟水反应时,水作氧化剂 | B.NaH中H—半径比Li+半径小 |
| C.跟液氨反应时,有NaNH2产生 | D.跟乙醇反应时,NaH被还原 |
下图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4·10H2O)在温度为T3 K 时开始分解为无水硫酸钠。现有142 g温度为T2 K的饱和硫酸钠溶液,当温度降为T1 K或升为T4 K(T4>T3)时析出晶体的质量相等,则温度为T4 K时Na2SO4的溶解度为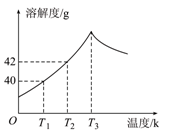
| A.小于40g | B.等于40g | C.等于42g | D.大于42g |
下列说法正确的是
| A.有阳离子的物质一定是离子晶体 | B.全部由极性键构成的分子一定是极性分子 |
| C.分子晶体的稳定性一定和共价键有关 | D.共价化合物不一定只有非金属元素组成 |