设nA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:H 1,O 16)
| A.标准状况下,22.4 L四氯化碳含有的分子数为nA |
| B.常温常压下,18g水含有的分子数为 nA |
| C.1mol Cu和足量稀硝酸反应产生NO分子数为nA |
| D.1L1.0mol·L-1 Na2CO3溶液中含有CO32-数为 nA |
能用于鉴别SO2与CO2的试剂是
| A.品红溶液 | B.BaCl2溶液 | C.澄清石灰水 | D.浓硫酸 |
下列物质的分类合理的是
| A.酸性氧化物:CO2、NO、SO2、H2O | B.碱性氧化物:Na2O、CaO、Na2O2 |
| C.碱:NaOH、Ba(OH)2、NH3•H2O | D.强酸: HNO3、 H2SO4、H2CO3 |
下列叙述不正确的是
| A.钾的焰色反应可以透过蓝色的钴玻璃片看到 |
| B.用玻璃尖嘴点燃氢气时,由于玻璃中有钠离子,所以火焰带有黄色 |
| C.做焰色反应时铂丝应用稀盐酸洗净,并灼烧至无色 |
| D.在钠和钠的化合物中,只有钠离子的焰色为黄色 |
下列关于浓硫酸的叙述正确的是
| A.浓硫酸具有吸水性,因而能使蔗糖炭化 |
| B.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 |
| C.含1molH2SO4的浓硫酸,与足量的铜反应放出的H2在标准状况下的体积约为22.4L |
D.浓硫酸在常温 下能够使铁、铝等金属钝化 下能够使铁、铝等金属钝化 |
设 NA为阿伏加德罗常数的数值,下列说法正确的是
A.NA个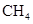 分子的质量为16g/mol 分子的质量为16g/mol |
B.1mol/L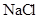 溶液含有NA个 溶液含有NA个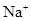 |
| C.等物质的量的N2和CO所含分子数均相同 |
D.常温常压下,22.4L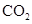 中含有 NA个 中含有 NA个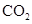 分子 分子 |