下列化学用语,不正确的是
A.氮分子的电子式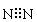 |
B.氯原子的结构示意图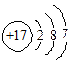 |
C.Na2S的电子式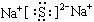 |
D.水分子的结构式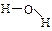 |
下列关于电泳的说法,不正确的是()
| A.生物化学中利用电泳来分离各种氨基酸和蛋白质 |
| B.医学上利用血清的纸上电泳进行某些疾病的诊断 |
| C.利用电泳的原理可将油漆、乳胶、橡胶等粒子均匀地沉积在镀件上 |
| D.胶体粒子能发生电泳现象说明胶体粒子是阳离子或阴离子的聚合体 |
一般情况下,胶体粒子不易聚集而稳定,主要是因为()
| A.胶体有丁达尔效应 |
| B.胶体有布朗运动 |
| C.胶粒很小,不受重力作用 |
| D.同种胶粒带同种电荷,它们互相排斥 |
已知由AgNO3溶液和稍过量的KI溶液制得的碘化银胶体与氢氧化铁溶胶混合时,会析出AgI和Fe(OH)3的混合沉淀。由此可知()
①该AgI胶粒带正电荷②该AgI胶粒电泳时向阳极移动③该碘化银胶粒带负电④Fe(OH)3胶粒电泳时向阳极移动
| A.①② | B.②③ | C.③④ | D.①④ |
下列关于胶体的说法正确的是()
| A.胶体是呈黏胶状的物质 |
| B.胶体的外观不透明、不均匀 |
| C.利用半透膜可以除去AgI胶体中的KNO3 |
| D.利用滤纸可以过滤除去蛋白质胶体中的食盐 |
下列应用技术与胶体分散系性质有关的是()
①利用电泳分离蛋白质②电泳用于汽车外壳的涂漆③医用微波手术刀,利用其在进行手术时所发生的微波,加热“割口”附近血液中的蛋白质使血液凝固,减少流血量④加明矾使江水变澄清
| A.①②③④ | B.③④ | C.①④ | D.②③④ |