(11分)在Ar、KCl、CO2、SiO2、NaOH等物质中[(1)题填物质的名称]
(1)构成各物质的微粒中,只存在离子键的是____ ;只存在共价键的是______ _;既存在离子键又存在共价键的是_____ ____;不存在化学键的是______ ___。
(2)在上述化合物中,固态时属于原子晶体的是____ ;属于分子晶体的是_____ __属于离子晶体的是____ ____。
(3)KCl的电子式是_______ _,CO2的电子式是____ ____。
现有反应aA(g)+bB(g)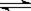 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是_______热反应,且a+b______p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比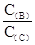 将________。
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色________,而维持容器体积不变,充入氖气时,混合物的颜色________(填“变浅”“变深”或“不变”)。
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是。
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态(填是或否)处于平衡状态?若不是,反应向哪个方向进行?
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。回答下列问题:
2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。回答下列问题: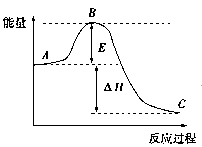
(1)图中A、C分别表示:_________________、__________________;
E的大小对该反应的反应热有无影响?_______________________;
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_____________;
理由是__________________________________________。
(2)图中ΔH=______________kJ/mol,该反应是______________反应(填“吸热”“放热”)。
(3)当反应达到平衡时,升高温度,A的转化率(填“增大”“减小”“不变”)。
(4)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol;
N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH2=-534 kJ/mol。
试计算1 mol肼和二氧化氮完全反应时放出的热量为_______________kJ,写出肼与二氧化氮反应的热化学方程式:___________________________。
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为:8CuFeS2+21O2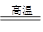 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是(填代号)。
a.高空排放b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I—氧化为I2:S2O82—+2I—=2SO42—+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程:、(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液碘水
所选试剂为。
证明炉渣中含有FeO的实验现象为。
某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链。其主要工艺如下: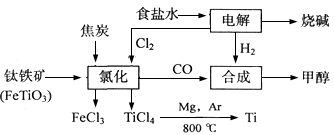
(1)写出电解食盐水反应的离子方程式。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:。
(3)已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH
反应2Mg+TiCl4 2MgCl4+Ti在Ar气氛中进行的理由是。
2MgCl4+Ti在Ar气氛中进行的理由是。
(4)在上述产业链中,合成192 t甲醇理论上需额外补充H2t(不考虑生产过程中物质的任何损失)。
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是。