(16分)已知 —C(OH)2—不稳定. 由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。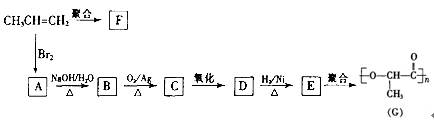
(1)聚合物F的结构简式是 。
(2)D的结构简式是 。
(3)B转化为C的化学方程式是
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式 。
(5)写出 C 与新制备的银铵溶液反应的化学方程式
(6)写出同时符合下列条件:①含有—OH的酯②水解产物稳定(一个碳原子上接两个羟基,存在―O―O-键的物质不稳定)
属于D的同分异构体的结构简式:
按要求对下图中两极进行必要的连接并填空:
(1)在A图中,使铜片上冒H2气泡。请加以必要连接,则连接后的装置叫。电极反应式:锌极:;铜极:。
(2)在B图中,a、b均为惰性电极,若a极析出铜,则b析出。加以必要的连接后,该装置叫。电极反应式,a极:b极:。经过一段时间后,停止反应并搅均溶液,溶液的H+浓度(升高、降低、不变),加入一定量的,溶液能恢复至与电解前完全一致。
图中A~X分别代表一种反应物或生成物,其中F、G、X为单质,短周期元素X原予的核电荷数是其最外层和最内层电子数之和的3倍。已知A受热分解得到等物质的量的B、C、D三种气态物质,D气体能使湿润的红色石蕊试纸变蓝色,其它为化合物,图中部分生成物未列出。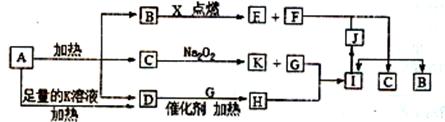
请回答:
(1)B的电子式,写出F的一种同素异形体____,
(2)写出反应B与X反应的化学方程式____。
(3)写出A与足量K溶液加热时反应的离子方程式____。
(4 )在一定条件下,2 L的H气体与0.5 L的G气体相混合,若该混合气体被NaOH溶液恰好完全吸收,只生成一种盐。请写出该反应过程中总的化学反应方程式:。
)在一定条件下,2 L的H气体与0.5 L的G气体相混合,若该混合气体被NaOH溶液恰好完全吸收,只生成一种盐。请写出该反应过程中总的化学反应方程式:。
(5)在F与J的反应中当转移了1.5 mol电子时,产生标准状况下的I气体的体积为_______L。
(Ⅰ)W、X、Y、Z是周期表前36号元素中的四种常见元 素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的
素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的 和黑色的ZO两种氧化物。
和黑色的ZO两种氧化物。
(1)W位于元素周期表第_________周期第_________族。
W的气态氢化物稳定性比 __________(填“强”或“弱”)。
__________(填“强”或“弱”)。
(2)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
_________________________________________________________________________。
(3)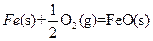
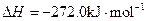

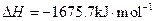
X的单质和FeO反应的热化学方程式是_________________________________________。
(Ⅱ)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为______________
(2)Y元素原子的价层电子的轨道表示式为_____________
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是________________________________________。
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ Na+ Cu2+ Al3+ |
| 阴离子 |
SO42-HCO3- NO3- OH- |
为了鉴别上述化合物,分别完成以下实验,其结 果是:
果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B,D 。
(2)将含1 mol A的溶液与含1 molE的溶液反应后蒸干,仅得到一种化合物 ,该化合物为。
,该化合物为。
(3)C常用作净水剂,用离子方程式表示其净水原理。
(4)在A溶液中加人少量澄清石灰水,其离子方程式为。
(5)向20mL 2mol/L C溶液中加入30mLE 溶液,充分反应后得到0.78g沉淀,则C溶液的物质的量浓度是mol/L
(7分)黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg·kgˉ1。黄血盐易溶于水,在水溶液中会电离出K+和[Fe(CN)6]4ˉ,其中CNˉ的电子式为 。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
(1)上述反应是否为氧化还原反应?______ (填“是”或“不是”)。
(2)食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过4000C时会分解,试配平该反应的化学方程式:
(3) 黄血盐可与高锰酸钾溶液反应,其化学方程式为
K4Fe(CN)6+ KMnO4+ H2SO4→KHSO4+ F e2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
e2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
①该反应的氧化产物有______(填化学式 )。
)。
②若有1mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为______mol。