已知氢氧化铁胶体是氢氧化铁胶粒吸附多余Fe3+生成的。现将氢氧化铁固体粉碎使粒子直径在10-9~10-7m,并悬浮于水中,再向悬浊液中加入______或______,即可制得Fe(OH)3胶体。(填两类不同物质)
分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物,某实验室的科技人员设计了下列合成路线:
|

(1)下列实验操作或叙述正确的是(填写编号,多选扣分)
①不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体;
②为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴 溶液;
溶液;
③用蒸馏水润湿的pH试纸测定溶液的pH一定有误差;
④向沸腾的NaOH稀溶液中滴加 饱和溶液,可以制得
饱和溶液,可以制得 胶体;
胶体;
⑤配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸;
⑥定容时,俯视容量瓶刻度,造成所配溶液浓度偏高;
⑦称取5.85g氯化钠固体,用100 mL蒸馏水溶解,得到1.00 mol·L-1氯化钠溶液
(2)某钠盐溶液可能含有阴离子NO3-,CO32-,SO32-,SO42-,Cl-,Br-,I-。为鉴定这些离子,分别取少量溶液进行以下各步骤的实验:
步骤1测得混合液呈碱性;
步骤2滴加HCl时,溶液中出现气泡。该气体能使饱和石灰水溶液变浑浊; 步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤4加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
步骤5加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
分析上述5个实验,回答下列问题。
①由实验步骤1判断可能存在的离子有;
②由实验步骤2判断可能存在的离子有几种可能性;分别是;
③由实验步骤3可得出的结论是 ;
④由实验步骤4和实验步骤5可确定肯定存在的离子有;
⑤由上述5个实验不能确定是否存在的离子是。
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4= ZnS↓+BaSO4↓。以下是工业生产流程。请回答有关问题:
Ⅰ.ZnSO4溶液的制备与提纯
有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等。 (1)②中使用的氧化剂最好是下列的(填序号),理由是。
(1)②中使用的氧化剂最好是下列的(填序号),理由是。
| A.Cl2 | B.H2O2 | C.KMnO4 | D.浓HNO3 |
(2)写出反应④的离子方程式:。
(3)为了达到综合利用、节能减排的目的,上述流程中步骤产生的可以用于步
骤(其中步骤选填①、②、③、④、⑤)。
Ⅱ.BaS溶液的制备 有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = —1473.2 kJ•mol-1
有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = —1473.2 kJ•mol-1
C(s)+ —O2(g)=CO(g); △H = —110.5 kJ•mol-1
Ba(s)+ S(s)=BaS(s);△H = —460 kJ•mol-1
(4)煅烧还原的热化学方程式为: 。
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:SO2(g) +1/2O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时
v(正)v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是(填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
 (4)若以右图所示装置,用电化学原理生产硫酸,写
(4)若以右图所示装置,用电化学原理生产硫酸,写
出通入O2电极的电极反应式为。
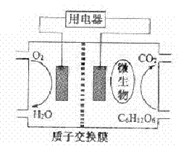
(1)已知1mol葡萄糖完全燃烧放热2800kJ。写出葡萄糖燃烧的化学反应方程式:___________________________________________________。现有72g葡萄糖(C6H12O6)与足量的氧气充分反应,共放热______________kJ。
(2)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示(电解质溶液为酸性),试写出该电池的两极反应式:_______________________________________________________质子在交换膜上向_________(填正或负)极区迁移。72g葡萄糖在该电池中可转移电子__________mol。