(共4分)(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上 (填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上 (填“有”或“没有”)气泡产生。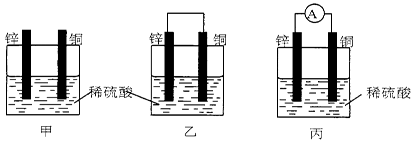
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连(如图丙所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过。有关的电极反应式:
锌片________________;铜片________________
I.已知:反应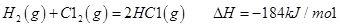
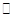
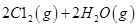
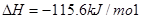
请回答: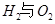 反应生成气态水的热化学方程式__________________________
反应生成气态水的热化学方程式__________________________
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: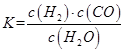
它所对应的化学方程式为:_________________________________________________
(2)已知在400℃时,反应
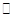
 =0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应
=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应 ____________
____________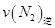 (填:>、<、=、不能确定);
(填:>、<、=、不能确定);
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积分数增加,
可采取的正确措施是____________(填序号)
A.加催化剂 B.升高温度 C.缩小体积增大压强 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应: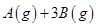
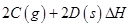 ,其化学平衡常数K与温度T的关系如下表:
,其化学平衡常数K与温度T的关系如下表:
请完成下列问题:
①判断该反应的 ___________0(填“>”或“<”)
___________0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是___________(填序号)。
A.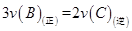 B.容器内压强保持不变
B.容器内压强保持不变
C.A和B的转化率相等 D.混合气体的密度保持不变
一种用于治疗高血脂的新药——灭脂灵H可按如下路线合成: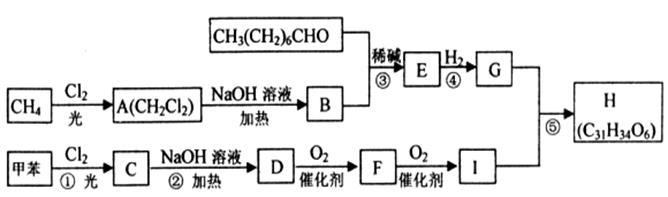
已知①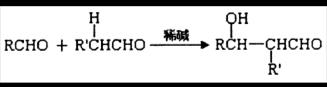
②一个碳原子上同时连接两个羟基,立即失去一分子水,生成另一种物质,如: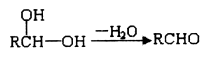
③G的分子式为C10H22O3
请回答:
(1)写出B、E的结构简式:B____________,E____________。
(2)G含有的官能团的名称是________________________。
(3)反应①~⑤中属于取代反应的有________________________(用编号表示)。
(4)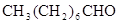 有多种同分异构体,符合下列性质的结构简式是:
有多种同分异构体,符合下列性质的结构简式是:
____________________________________(写一种)。
A.能发生银镜反应 B.烃基上的一氯取代物只有两种
(5)写出下列反应的化学方程式:
反应②的化学方程式为____________________________________。
D→F的化学方程式为____________________________________。
反应⑤的化学方程式为____________________________________。
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下: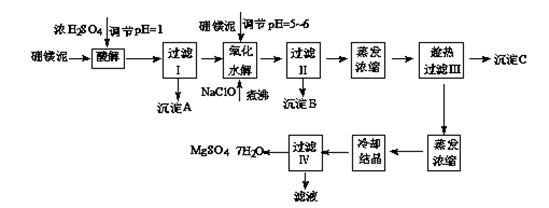
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为。加热煮沸的主要目的是。
(2)沉淀B中除MnO2、SiO2外还含有(填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是;
(4)沉淀C的化学式是。过滤III需趁热过滤的理由是
某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下: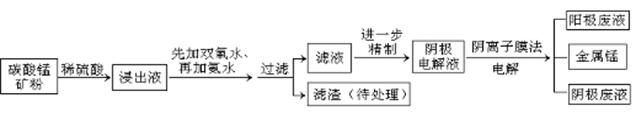
阴离子膜法电解装置如图所示: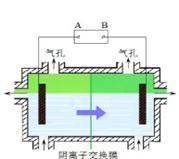
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式。
(2)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因.
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表: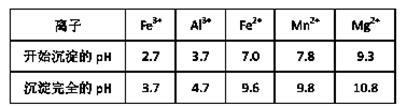
加氨水调节溶液的pH等于6,则滤渣的成分是,滤液中含有的阳离子有H+和 。
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为。
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资浪费,写出该副反应的电极反应式。
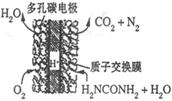
尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l)△H2
H2O+ H2NCONH2(l)△H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。
已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定,总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: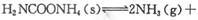
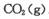 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强/Kpa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度/10-3mol/L |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡状态的标志是____________。
A.2V(NH3)=V(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0°C时该分解反应的平衡常数为______(保留小数点后一位)。
(3)已知:
N2(g)+O2(g)=2NO(g)△H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g)△H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g)△H3=-483.6KJ/mol
则4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)的△H=___kJ • mol-1。
(4)尿素燃料电池的结构如图所示。其工作时负极电极反应式可表示为______。