七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下: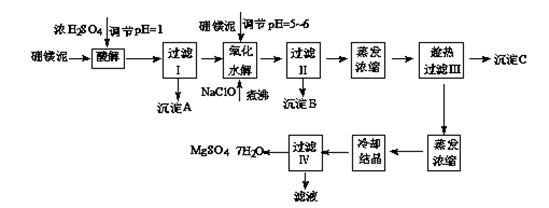
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 。加热煮沸的主要目的是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 。过滤III需趁热过滤的理由是
现有X、Y、Z三种非金属元素,A、B、C三种金属元素,已知有如下情况:
(1)X、Y、Z的单质在常温下均为气体
(2)X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
(3)XZ易溶于水,XZ的水溶液可使石蕊试液变红。
(4)两摩尔X的单质可与一摩尔Y的单质化合生成两摩尔X2Y,X2Y常温下为液体。
(5)Z的单质溶于X2Y中所得溶液具有漂白性。
(6)A的单质可以在Z的单质中燃烧,生成棕褐色固体,该固体溶于水呈棕黄色。
(7)B与Z形成的化合物BZ2溶于水加入NaOH溶液有蓝色沉淀生成。
(8)C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色。
请完成下列问题:
①写出XZ、X2Y和BZ2的化学式:XZ,X2Y,BZ2。
②Z的单质溶于X2Y中所得溶液中起漂白作用的物质是(填化学式)
③A的单质与Z的单质反应的化学方程式:。
④C的单质与Y单质反应生成淡黄色物质的化学方程式:。
⑤Z单质能否与NaOH溶液反应?(填“能”或“不能”)。若能,请写出反应的化学方程式:。(若不能反应,则此空不必填写)。
把少量金属钠投入下列溶液中,写出有关反应的化学方程式:
(1)钠投入稀盐酸中。
(2)钠投入硫酸铜溶液中。
在mol AL2(SO4)3中含0.3molSO42-,其中含Al3+个。
等物质的量的CO和CO2中所含O原子个数之比,C原子数之比,二者的质量之比,在同温同压下的体积之比。
化合物A的相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧.A的相关反应如下图所示: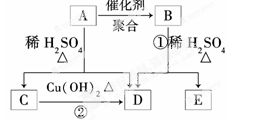
已知:
a. R— CH = CHOH不稳定,很快转化为R— CH2CHO,
b. R— CH2CHO可以和新制Cu(OH)2碱性悬浊液加热生成水、R—CH2COOH和Cu2O,
c. H—C≡C—H四原子在一条直线上。
根据以上信息回答下列问题:
(1)A的分子式为__________________________________________________;
(2)反应②的化学方程式是__________________________________________;
(3)A的结构简式是______________________________________________;
(4)反应①的化学方程式是___________________________________________;
(5)A有多种同分异构体,写出四个同时满足(i)能发生水解反应(ii)能使溴的四氯化碳溶液褪色两个条件的同分异构体的结构简式:______________、____________、________________、________________;
(6)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为。