尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l)△H2
H2O+ H2NCONH2(l)△H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。
已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定, 总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: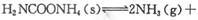
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强/Kpa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度/10-3mol/L |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡状态的标志是____________。
A.2V(NH3)=V(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0°C时该分解反应的平衡常数为______(保留小数点后一位)。
(3)已知:
N2(g)+O2(g)=2NO(g) △H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) △H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g) △H3=-483.6KJ/mol
则4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)的△H=___kJ • mol-1。
(4)尿素燃料电池的结构如图所示。其工作时负极电极反应式可表示为______。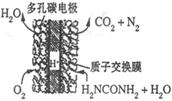
已知柠檬醛的结构简式如下: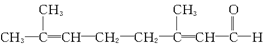
(1)检验柠檬醛分子中含有醛基的方法是________________________________________。
(2)已知溴水可氧化醛基,若要检验柠檬醛分子中含碳碳双键的方法是__________________。
有两种有机化合物A和B,分子式分别为C2H6O和C2H4O,已知:
①B氧化得C,还原得A;
②A能脱水生成烯烃F;
③F能跟溴水反应得D;
④D与氢氧化钠水溶液反应,得到溶于水的产物E。
(1)写出A和B的结构式。
(2)写出上述①至④各反应的化学方程式,并对E命名。
下面是合成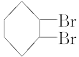 的流程图示:
的流程图示: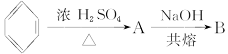 (另有Na2SO4和水生成)
(另有Na2SO4和水生成)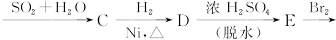

(1)写出五种物质中有机物的结构简式:
A__________;B__________;C__________;D__________;E__________。
(2)写出生成B和C的反应方程式__________________________________________________。
将煤焦油中混有的苯、甲苯与苯酚进行分离,可采取如图所示的方法进行操作: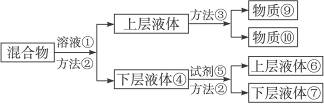
(1)写出物质①和⑤的化学式:①为________,⑤为________。
(2)写出分离方法:②为________法,③为________法。
(3)混合物中加入溶液①反应的化学方程式________________________。
(4)下层液体④变成⑥⑦的方程式为______________________________。
(5)分离出的苯酚在________里(写编号)。
已知提供H+的能力:H2CO3>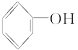 >
>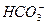 >H2O>CH3CH2OH,试写出下列可发生的反应方程式。
>H2O>CH3CH2OH,试写出下列可发生的反应方程式。
(1)CO2通入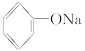 溶液中__________________;
溶液中__________________;
(2)Na2CO3溶液滴入苯酚溶液中___________________;
(3)乙醇钠投入水中______________________________;
(4)金属钠投入熔融苯酚中________________________。