下面是合成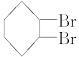 的流程图示:
的流程图示: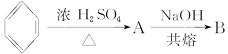 (另有Na2SO4和水生成)
(另有Na2SO4和水生成)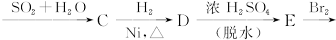

(1)写出五种物质中有机物的结构简式:
A__________;B__________;C__________;D__________;E__________。
(2)写出生成B和C的反应方程式__________________________________________________。
咖啡酸具有止血功效,存在于多种中药中,其结构简式为: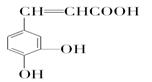
(1)写出咖啡酸中两种含氧官能团的名称:__________________ 、________________。
(2)1mol咖啡酸分别与足量H2、浓溴水和氢氧化钠溶液反应,消耗三种试剂的物质的量依次为:H2__________mol;Br2______________mol;NaOH_____________mol。
(3)蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种醇A,则醇A的分子式为______________________________。
(4)已知醇A含有苯环,且分子结构中无甲基,写出醇A在一定条件下与乙酸反应的化学方程式:________________________________________________________________。
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_____________,K值大小与温度的关系是:温度升高,K值______________(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g) 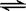 CO2(g)十H2 (g)△H < 0;CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
CO2(g)十H2 (g)△H < 0;CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)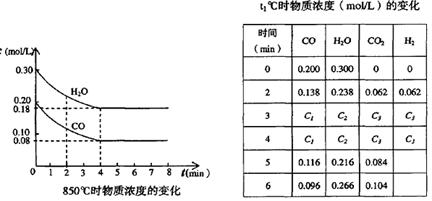
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min问,平衡向逆方向移动,可能的原因是________(单选), 表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
| A.增加水蒸气 | B.降低温度 |
| C.使用催化剂 | D.增加氢气浓度 |
在容积为1 L的密闭容器中,进行如下反应: A(g)+2B(g) 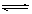 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。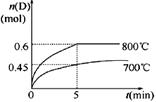
请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为_______。
(2)能判断反应达到化学平衡状态的依据是__________。
A.容器中压强不变 B.混合气体中c(A)不变
C.v正(B)=2v逆(D) D.c(A)=c(C)
(3)若最初加入1.0 mol A和2.2 mol B,利用图中数据计算800℃时的平衡常数K=__________,该反应为__________反应(填“吸热”或“放热”)。
(4) 800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应__________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题: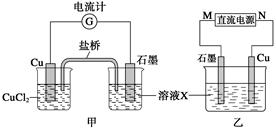

①图中X溶液是_____________________________;
②石墨电极上发生的电极反应式为__________________________________________;
③原电池工作时,盐桥中的____________(填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是__________极;
②图丙中的②线是______________的变化。
③当电子转移为2 mol时,向乙烧杯中加入________ L 5 mol·L-1 NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O=Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________________________________。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_______________________________________。
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,在恒容容器中,该反应的热化学方程式为:
CO(g)+2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中能说明反应达到平衡状态的是___________
| A.体系压强保持不变 |
| B.混合气体的密度保持不变 |
| C.CO与H2的浓度之比为1∶2 |
| D.单位时间内,消耗2molH2的同时消耗1mol CH3OH |
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如图所示。已知容器体积1L,起始时CO的物质的量均为1mol。据此判断在上述三种温度中,曲线Z对应的温度是 ;利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K(写出计算过程)。
(2)已知: CO(g)+  O2(g)=CO2(g)△H2=-283 kJ·mol-1H2(g)+
O2(g)=CO2(g)△H2=-283 kJ·mol-1H2(g)+  O2(g)=H2O(g)△H3=-242 kJ·mol-1
O2(g)=H2O(g)△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气的热化学方程式为 __________