(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_____________,K值大小与温度的关系是:温度升高,K值______________(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g) 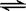 CO2(g)十H2 (g) △H < 0 ;CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
CO2(g)十H2 (g) △H < 0 ;CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min问,平衡向逆方向移动,可能的原因是________(单选), 表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
| A.增加水蒸气 | B.降低温度 |
| C.使用催化剂 | D.增加氢气浓度 |
已知反应4NH3(g)+5O2(g)==4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了4.5mol,试计算分别用NH3、O2、NO、H2O四种不同物质表示的该反应的反应速率。
将氮气、氢气的混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后,反应速率为:甲:v (H2)=3mol/(L· min);乙:v (N2) =2mol/(L·min);丙: v (NH3)= 1mol/(L·min),则这段时间内三个容器中反应速率由大到小的顺序是。
根据以下叙述回答。
能源可划分为一级能源和二级能源。自然界中以现成形式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:
(1)下列叙述正确的是()
A.电能是二级能源B.水力是二级能源
C.天然气是一级能源D.水煤气是一级能源
(2)关于用水制取二级能源氢气,以下研究方向不正确的是()
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制氢气
(3)1g氢气燃烧时约放热142.9kJ,而1kg汽油燃烧时约放热46000kJ。氢气被公认是21世纪替代矿物燃料的理想能源。你认为氢气作为能源的三个主要优点:_______________,________________,________________。
如图所示,在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体②浓硫酸③硝酸铵固体④NaCl固体,其中能使a端液面高于b端液面的是__________________。(填序号)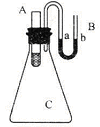
A元素的最高价离子0.5mol被还原成中性原子时,要得到6.02×1023个电子,它的单质同盐酸充分反应时,放出0.02gH2,用去0.4gA。B元素的原子核外电子层数与A相同,且B元素形成的单质是红棕色液体。
(1)写出两种元素的名称:A.B.。
(2)用结构示意图表示A、B两元素常见离子:
A.,B.。
(3) A、B形成的化合物中化学键的类型是。