A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下(图中部分产物未列出):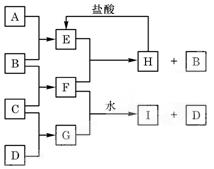
请填写下列空白
(1)A是 ,B是 , C是  。
。
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液反应生成I和D的离子方程式 是 。
是 。
已知某有机物的结构简式为: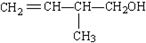
(1)该有机物中所含有的官能团的名称是____________、____________;
(2)该有机物发生加成聚合反应后,所得产物的结构简式为_______________________。
按要求写出: 的结构简式_________;
的结构简式_________;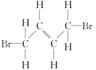 的键线式______;
的键线式______;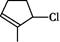 的分子式___________。
的分子式___________。
目前世界上比较先进的电解制碱技术是离子交换膜法。
(1)电解前,如果粗盐中SO42ˉ含量较高,必须添加试剂除去SO42ˉ,则按添加试剂顺序,依次发生反应的离子方程式为。
(2)补齐下列电解饱和食盐水制烧碱的离子方程式:
______________________  __________________________________
__________________________________
(反应物)(阴极产物)(阳极产物)
(3)在电解制得的NaOH中往往还含有一定量的NaCl,因此必需进行脱盐工序,脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过、冷却、(填写操作名称)除去NaCl。
(4)已知NaCl在60℃的溶解度为37.1 g,现电解60℃精制饱和食盐水1371 g。经分析,电解后溶液密度为1.37 g·cm-3,其中含有20gNaCl,则电解后NaOH的物质的量浓度为__________mo1·L-1(保留小数点后1位)。
化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾。制备皓矾的实验流程如下图所示。
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7 Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0试回答下列问题:
(1)加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,最好选用,其理由是;
(2)加入的试剂②,供选择使用的有:a、Zn粉,b、ZnO,c、Zn(OH)2,d、ZnCO3,e、ZnSO4等,可选用;
(3)从晶体1→晶体2,该过程的名称是;
(4)在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是。
磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等。
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10 10C+P4O10=P4↑+10CO↑
上述反应中的各种物质,属于酸性氧化物的有。
(3)白磷有剧毒,不慎沾到皮肤上,可用CuSO4溶液冲洗解毒。白磷可与热的CuSO4溶液反应生成磷化亚铜,与冷溶液则析出铜,反应方程式分别(均未配平)为:
① P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4
② P4+CuSO4+H2O→Cu+H3PO4+H2SO4
反应①中,氧化剂为,若上述两反应中被氧化的P4的物质的量相等,则消耗的CuSO4的物质的量之比为。