(13分) 如图所示,各物质间有下列转化关系: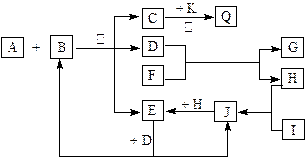
A、F分别为淡黄色固体,A与B的浓溶液反应可以生成C、D、E三种物质,D为无色液体,K为红色金属单质,能在加热条件下与C的浓溶液反应,生成气体Q。I和H为气态双原子分子。反应过程中部分条件和产物均略去。
(1) I的电子式:____________________。
(2) 反应A + B的化学方程式:_________________________________________________。
(3) 将Q和E按2∶1同时通入品红溶液中,若产物之一含I,则现象可能为___________,原理是(用化学方程式表示)______________________________________________。
(4) 若标准状况下将11.2 L Q通入到500 mL 1.5 mol /L 的G溶液中,请将最终溶液的溶质成分及物质的量填入下表(可不填满)。
| 溶质(化学式) |
物质的量 |
| |
|
| |
|
| |
|
(12分)某科研小组在900℃的空气中合成出化学式为La2Ca2MnOx的超导体材料,其中La以+3价存在。为确定x的值,进行如下分析:
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol•L-1Na2C2O4溶液(过量)和25mL6mol•L-1HNO3溶液,在60-70℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2)。
步骤2:用0.02000mol•L-1KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液。
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol•L-1。常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为[已知Mn(OH)2的Ksp=2.0×10-13]
(2)步骤2滴定终点的现象是。
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将(填“偏大”、“偏小”或“不变”)。
(4)求x的值(写出计算过程)。
(15分)葛根大豆苷元(F)用于治疗高血压引起的头疼、突发性耳聋等症,其合成路线如下: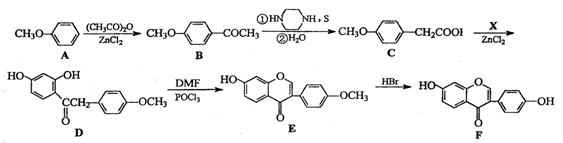
(1)化合物C中的含氧官能团有 、 (填官能团名称)
(2)已知:C→D为取代反应,其另一产物为H2O,写出X的结构简式:
(3)反应E→F的反应类型是
(4)写出同时满足下列条件的B的两种同分异构体的的结构简式: 。
Ⅰ.属于芳香族化合物,分子中有4种不同化学环境的氢;
Ⅱ.能与FeCl3溶液发生显色反应;
Ⅲ.不能发生水解反应,能发生银镜反应。
(5)根据已有知识并结合相关信息,写出以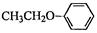 和(CH3CO)2O为原料制备药物中间体
和(CH3CO)2O为原料制备药物中间体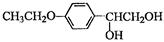 的合成路线流程图(无机试剂任
的合成路线流程图(无机试剂任
用)。合成路线流程图示例如下:
(12分)聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下: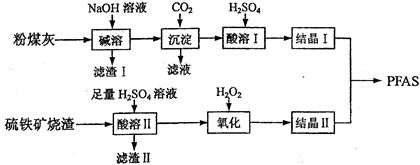
(1)“碱溶”时,Al2O3发生反应的化学方程式为。
(2)“酸溶Ⅱ”时,Fe3O4发生反应的离子方程式为。
(3)“滤渣Ⅰ”、“滤渣Ⅱ”在本流程中能加以利用的是。
(4)“氧化”时应控制温度不超过57℃,其原因是。
(5)“氧化”时若用酸性高锰酸钾溶液代替,发生反应的离子方程式是。
(6)酸度对絮凝效果和水质有显著影响。若产品中残留过多,使用时产生的不良后果是
选做:A为烃,B为烃的含氧衍生物,由等物质的量的A和B组成的混合物0.05mol在0.125mol的氧气中恰好完全燃烧,生成0.1molCO2和0.1molH2O。试通过计算回答:取a mol 以任意物质的量比混合的A和B的混合物,在过量的氧气中完全燃烧。①若耗氧量为定值,则耗氧量为mol(用含a的代数式表示)②若耗氧量一定,则A、B的分子式分别是、
③若生成的二氧化碳和水的物质的量一定,则A、B的分子式分别是、
等质量的甲、乙、丙、丁、戊、己6种只含C、H、O三种元素的有机物,分别充分燃烧时,消耗等量的O2,且生成的气体全部分别通过足量的无水硫酸铜后再分别通过足量的碱石灰,无水硫酸铜与碱石灰质量增重之比均为9∶22。已知:
① 6 M(甲)=3 M(乙)=3 M(丙)=3 M(丁)=2 M(戊)=M(己)=180;
② 乙、戊的水溶液可使甲基橙试液变红,相互之间在一定条件下能发生酯化反应;
③ 戊的核磁共振氢谱有4种峰,峰面积之比为3∶1∶1∶1;
④ 甲、丙、丁、己能发生银镜反应。丙不易溶于水但丁易溶于水。
请回答下列问题:
(1)甲的结构式为;己的一种可能的结构简式为。
(2)乙、丙、丁三者之间的关系是;丁的结构简式为。
(3)写出2分子戊生成1分子环状酯的化学方程式。