用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是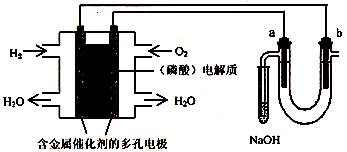
| A.电池工作时,正极反应式为:O2 +2 H2O + 4e-= 4OH- |
| B.忽略能量损耗,当电池中消耗0.02g H2 时,a 极周围会产生0.02g H2 |
| C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D.电解时,a 电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl- |
有关普通玻璃的叙述中,错误的是
| A.玻璃是混合物 | B.制造玻璃的原料是纯碱、石灰石、石英、粘土 |
| C.玻璃不是晶体 | D.玻璃没有一定的熔点 |
下列物质既能使酸性高锰酸钾溶液褪色,又能使溴水褪色的是
| A.乙酸乙酯 | B.植物油 | C.乙酸 | D.苯 |
下列关于食谱的说法错误的是
| A.营养学家编制的食谱对每个人都适用 |
| B.每一种食物含有多种营养素,每种营养素又存在于多种食物中,因此对营养素的摄取应综合考虑 |
| C.靠不吃或少吃减肥是不正确的,有害健康 |
| D.编制好的食谱不能永久使用 |
下列“化学与生活”的说法不正确的是
| A.硫酸钡可用于钡餐透视 | B.盐卤可用于制豆腐 |
| C.明矾可用于水的消毒、杀菌 | D.醋可用于除去暖水瓶中的水垢 |
化学在人类生活中扮演着重要角色,以下应用正确的是
| A.用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可到达水果保鲜的目的 |
| B.为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 |
| C.使用无磷洗衣粉,可彻底解决水体富营养化问题 |
| D.天然药物无任何毒副作用,可长期服用 |