在第三周期中,置换酸中氢的能力最强的元素的元素符号为 ,化学性质最稳定的元素符号是 ,最高价氧化物的水化物的酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ,该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为 . ,原子半径最大的金属元素的名称是 ,金属离子半径最小的离子结构示意图是 。
(1) “笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2分子具有相似的结构(包括电子式);又已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为,它(填“含有”或“不含”)非极性键。
(2)有以下物质:①CH4,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧Na2O2,⑨HCN(H—C≡N);只含有极性键且为非极性分子是__________;含有非极性键的共价化合物是__________;既有σ键又有π键的化合物是__________;
现有甲、乙、丙、丁四种晶胞(如图所示),可推知:甲晶体中A与B的离子个数比为;乙晶体的化学式为;丙晶体的化学式为______;丁晶体的化学式为______。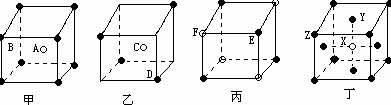
m mL三种气态烃混合物与足量氧气混合点燃后,恢复到原来状况(常温、常压)气体体积共缩小2m mL,这三种烃可能的组合是________ 、_____________、 ______________(写三组)
(1)分别写出相对分子质量为128、72的烃的分子式:______、_ ___、__ ___(可不写满,也可补充)
(2)立方烷的结构简式如图所示,每个顶点是一个碳原子。则: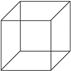
①其分子式为_____________。②它的一氯取代物有_____________种。③它的二氯取代物有_____________种。
A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体。
(1)化合物I的结构简式是__________________,反应B→C的化学方程式是__________________;
(2)设计实验证明H中含有溴原子,还需用到的试剂有___________________________;
(3)为验证E→F的反应类型与E→G不同,下列实验方法切实可行的是_________________。
| A.向E→F反应后的混合液中加入硝酸酸化,再加入AgNO3溶液得到淡黄色沉淀 |
| B.向E→F反应后的混合液中加入溴水,发现溴水立即褪色 |
| C.向E→F反应后的混合液中加入盐酸酸化后,加入溴的CCl4溶液,溶液褪色 |
| D.向E→F反应后的混合液中加入酸性KMnO4溶液,混合液红色变浅 |