A~F是中学化学中常见物质,常温下A、C、E、F为气体,B、D为液体,其中B的分子为4原子分子,D在常温下不具有挥发性。F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末。这些物质之间满足如图所示的转化关系,图中部分生成物已略去。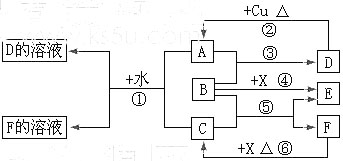
(1)写出下列物质的化学式:A ,F 。
(2)B的电子式为 。根据图中信息,B、C、X的氧化性由强到弱的顺序是 (用化学式表示)。
(3)写出反应①的离子方程式 ;
写出反应⑥的离子方程式 。
(4)在反应⑥中,F表现的性质是 ,当生成0.75 mol C时,被氧化的还原剂的物质的量是 。
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下: 有关氢氧化物开始沉淀和沉淀完全的pH如下表:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Al(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Pb(OH)2 |
Mn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
8.0 |
8.3 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
8.8 |
9.8 |
请问答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是。
(2)酸浸后的溶液中含有Mn2+、 SO42-,另含有少量Fe2+、Fe3+、A13+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为。 ②加入CaO将溶液的pH调到5.2~6.0,其主要目的是。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去。
(3)从溶液A中回收的主要物质是,该物质常用作化肥。(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2,写出Mn3O4与稀硫酸反应的化学方程式。
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS),共同生产MnO2和Zn(干电池原料)。
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②IV中的电解反应式为MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。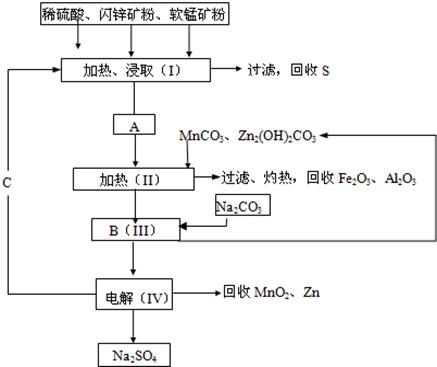
(1)A中属于还原产物的是。
(2)MnCO3、Zn2(OH)2CO3的作用是;Ⅱ需要加热的原因是;C的化学式是。
(3)Ⅲ中发生的离子方程式为,;
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是。
黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有: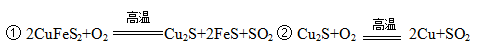
(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是。
(2)反应②中还原剂是。
(3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。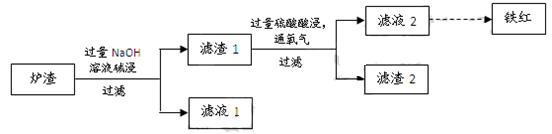
① 炉渣碱浸时反应的离子方程式是、。
② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中。
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示: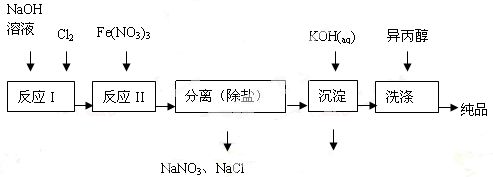
①洗涤粗品时选用异丙醇而不用水的理由是。
②反应II的离子方程式为。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂,它能消毒杀菌是因为它能净水的原因是。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液c(Fe3+)=4.0×10-5mol/L,则需要调整到时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠(填“大”或“小”)。
| 湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定,放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式。
氯碱工业中电解饱和食盐水的原理示意图如下图所示: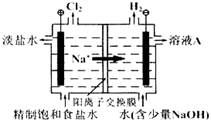
(1)溶液A的溶质是;
(2)电解饱和食盐水的离子方程式是;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42->c(Ca2+)]。精致流程如下(淡盐水和溶液A来自电解池):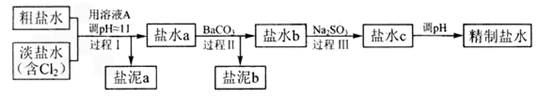
①盐泥a除泥沙外,还含有的物质是。
②过程Ⅰ中将NH4+转化为N2的离子方程式是。 ③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有。