下列关于海水资源利用的认识,错误的是
| A.海水中金、锶、碳、铜、铁等元素属于微量元素 |
| B.海底多金属结合矿含有铁、锰、钴等多种金属元素 |
| C.通过蒸馏法、电渗析法、离子交换法等可以实现海水的淡化 |
| D.海水提溴过程溴元素依次发生氧化反应、还原反应、氧化反应 |
下列各组物质的相互关系正确的是
| A.同位素:1H+、2H-、2H2、2H 、3H |
| B.同分异构体:乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯 |
| C.同素异形体:C20、C60、C金刚石、C石墨 |
| D.同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 |
已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大。G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体;在元素周期表中Z元素位于第10列。
回答下列问题:
(1)Z的核外电子排布式是。
(2)X以及与X左右相邻的两种元素,其第一电离能由小到大的顺序为。
(3)QR2分子中,Q原子采取杂化,写出与QR2互为等电子体的一种分子的化学式:。
(4)分子式为Q2G6R的物质有两种,其中一种易溶于水,原因是;T的氯化物的熔点比Y的氯化物的熔点高,原因是。
(5)据报道,由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如图所示。晶体中距每个X原子周围距离最近的Q原子有个。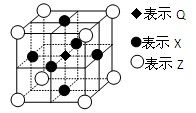
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。
2C(g)。
各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025mol/(L·min)
B.由图可知:T1<T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.pH=5的NaHSO3溶液中:c(HSO3—)>c(H2SO3)>c(SO32—) |
| B.使酚酞呈红色的苯酚与苯酚钠混合溶液中:c(Na+)>c(C6H5O-)>c(OH―)>c(H+) |
| C.在0.1 mol·L-1 Na2CO3溶液中:c(HCO3-)=c(H2CO3)+c(H+)-c(OH-) |
| D.等物质的量浓度、等体积的NaOH溶液与CH3COOH溶液混合所得溶液中: |
c(Na+)=c(CH3COO-)+c(CH3COOH)
下列有关实验操作、实验结论和说法正确的是
| A.粗略配制浓度为2 mol·L—1的NaCl溶液,可将58.5gNaCl加入到盛有500mL水的烧杯中,搅拌、溶解 |
| B.将滴定管洗净,再用蒸馏水润洗后,即可注入标准液进行滴定 |
| C.向乙酸乙酯中加入稀NaOH溶液,振荡,分液,可除去乙酸乙酯中的少量乙酸 |
| D.为验证氯仿中含有的氯元素,可向氯仿中加入NaOH溶液,加热充分反应后,再加入AgNO3,观察到白色沉淀 |