在一个10L的密闭恒定温度的容器中加入1.0mol Z、1.0mol X、0mol Y开始反应,X、Y、Z三种物质物质的量随时间变化关系如右图,在5min时Z、X、Y物质的量分别是0.1mol、0.7mol、0.6mol,下列说法正确的是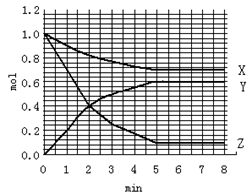
| A.前5min内,Z的平均反应速率是0.9 mol/L.s |
| B.该反应的化学方程式可表达式:3Z + X D 2Y |
| C.在第2min时,Y和Z的物质的量浓度相等,表明反应处于平衡状态 |
| D.第5min后,X、Y、Z的浓度保持不变,正反应速率等于逆反应速率 |
有一硝酸盐晶体,其化学式为R(NO3)x·yH2O,相对分子质量为242。 取1.21 g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.32g。下列叙述正确的是
| A.x=3 |
| B.金属R的相对原子质量为56 |
| C.y=2 |
| D.电解后溶液的pH=1(电解过程中溶液体积变化忽略不计) |
为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入①适量的HCl②适量的NaCl③适量的氨水④适量的NaOH,正确的是
| A.①② | B.③ | C.③④ | D.④ |
如右图所示,下列叙述正确的是
| A.Y为阴极,发生还原反应 |
| B.X为正极,发生氧化反应 |
| C.Y与滤纸接触处有氧气生成 |
| D.X为滤纸接触处变红 |
下列说法或解释不正确的是
| A.物质的量浓度均为1mol•L-1的NaCl和MgCl2中:c(Cl-)=3c(Na+) |
| B.等物质的量浓度的下列溶液中,①NH4Al(SO4) 2、②NH4Cl、③CH3COONH4、④ NH3·H2O,c(NH+4)由大到小的顺序是①>②>③>④ |
| C.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+) |
| D.向0.2 mol•L-1 NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液:c(CO)>c(HCO)>c(OH-)>c(H+) |
25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线下图所示,下列说法正确的是
| A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等 |
| B.在①点时pH=6,溶液中:c(F-)-c(Na+) = 9.9×10-7mol/L |
| C.在②点时,溶液中:c(F-) < c(Na+) |
| D.在③点时V=20mL,溶液中:c(F—) < c(Na+)=0.1mol/L |