为进行Ⅰ项中的除杂实验(括号内为杂质),请从Ⅱ项中选出一种试剂,从Ⅲ项中选出合适的实验操作方法分离,将标号填在后面的答案栏内。
| Ⅰ除杂实验 |
Ⅱ试剂 |
Ⅲ操作方法 |
答案 |
||||||
| Ⅰ |
Ⅱ |
Ⅲ |
|||||||
| ①苯(苯酚) |
|
a.蒸馏 b.分液 c.盐析 d.过滤 |
① |
|
|
||||
| ②乙醇(水) |
② |
|
|
||||||
| ③肥皂(甘油、水) |
③ |
|
|
||||||
| ④乙酸乙酯(乙酸) |
④ |
|
|
拆开1mol共价键所需吸收的能量如下表:
| 共价键 |
H—H |
N三N |
N—H |
| 吸收的能量/kJ |
436 |
946 |
391 |
(1) 1mol N2完全反应为NH3(填:吸收或放出)kJ能量
(2)事实上,将1molN2和3molH2放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是
阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①:X一定不是(填序号).
| A.氢 | B.碳 | C.氧 | D.硫 |
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶
于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否可能有一种是铝元素?。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向
滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向
滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为。
信息⑤:X与W同主族
(5)X与浓硫酸加热时反应的化学方程式为。
对于反应2SO2+O2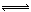 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
降低温度 |
|
| ② |
压缩体积 |
|
| ③ |
增大氧气的浓度 |
|
| ④ |
使用催化剂 |
欲制无水氯化铝并保存备用。现有仪器如下图所示,并有浓盐酸、水、固体烧碱、铝粉、二氧化锰、浓硫酸、碱石灰(主要成分为CaO, NaOH)、食盐固体等八种试剂。
设计的制取过程是:制氯气 → 净化和干燥氯气 →制氯化铝
查资料得知:无水AlCl3极易与水作用而变质:AlCl3易升华
 |
请回答下列问题:
(1)从上列仪器中选取必须的几种,连接成一个制无水氯化铝的连续装置,按前后顺序填写图的编号(可以重复使用)。
仪器编号 、 、 、 、 、 ④
(2)写出实验过程中有关反应的化学方程式(任意2个)。
(3)以上连接装置中最后连接④的作用是
a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;试写出:
(1)、写出下列粒子的电子式:
①c__________;②d__________;③e__________;④a__________。
(2)、b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:__________>__________(用化学式表示)。
(3)、用电子式表示b元素与氧形成的化合物b2O的形成过程:________________。