一定温度下,反应N2(g)+3H2(g)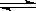 2NH3(g)达到化学平衡状态的标志是( )
2NH3(g)达到化学平衡状态的标志是( )
| A.N2,H2和NH3的物质的量浓度不再改变 |
| B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2 |
| C.N2与H2的物质的量之和是NH3的物质的量2倍 |
| D.NH3的生成速率等于H2的分解速率 |
取一小块钠放在燃烧匙里加热,观察到下列实验现象:①金属钠先熔化;②在空气中燃烧,发出黄色火光;③燃烧后得到白色固体;④燃烧后生成淡黄色固体。描述正确的是()
| A.①③④ | B.①②③ | C.②③④ | D.①②④ |
能与铝粉混合组成铝热剂的氧化物是()
| A.SiO2 | B.MgO | C.Al2O3 | D.Fe2O3 |
既能与盐酸又能与NaOH溶液反应的是()
①Al② Al2O3③ Al(OH)3④ SiO2⑤ CaCO3
| A.①②③ | B.②③④ | C.③④⑤ | D.①③⑤ |
通常要用氧化剂才能实现的反应是()
| A.NaCl→HCl | B.Cl2→HCl | C.Cl-→Cl2 | D.ClO3-→Cl2 |
要除去氯气中混有少量的水蒸气,应当使气体通过()
| A.浓硫酸 | B.饱和食盐水 | C.固体氢氧化钠 | D.干燥的石灰 |