已知25 ℃、101 k Pa下,石墨、金刚石燃烧的化学方程式分别为:C(石墨) + O2(g) = CO2(g),1 moL C(石墨) 完全燃烧放热393.51 kJ;C(金刚石) + O2(g) = CO2(g),1 moL C(金刚石) 完全燃烧放热 395.41 kJ。据此推理所得到的下列结论中,正确的是( )。
Pa下,石墨、金刚石燃烧的化学方程式分别为:C(石墨) + O2(g) = CO2(g),1 moL C(石墨) 完全燃烧放热393.51 kJ;C(金刚石) + O2(g) = CO2(g),1 moL C(金刚石) 完全燃烧放热 395.41 kJ。据此推理所得到的下列结论中,正确的是( )。
| A.金刚石比石墨稳定 | B.由石墨制备金刚石一定是吸热反应 |
| C.石墨的能量比金刚石的能量高 | D.石墨转化为金刚石是物理变化 |
下列关于“物质的量”“摩尔”“摩尔质量”的叙述正确的是
| A.物质的摩尔质量等于其相对分子(原子)质量 |
| B.“物质的量”是国际单位制中的一个基本单位 |
| C.0.012kg 12C 中所含的碳原子数为NA |
| D.1mol任何物质都含有约6.02×1023个原子 |
在实验室中将浑浊的自来水制成蒸馏水,最好的方法是
| A.过滤 | B.蒸馏 | C.蒸发 | D.先过滤后蒸馏 |
有关实验的叙述,正确的是
| A.将固体加入容量瓶中溶解并稀释至刻度线,配制成一定的物质的量浓度的溶液 |
| B.用玻璃棒蘸取溶液点在湿润的PH试纸上测定其PH |
| C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 |
| D.读取量筒内液体的体积,俯视读数导致读数偏大 |
下列各表述与示意图一致的是()
| A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 |
| B.图①中使用的NaOH的浓度为2 mol·L-1 |
| C.图②中曲线表示某反应过程的能量变化。若使用催化剂,B点会降低 |
| D.图②中物质A反应生成物质C,△H>0 |
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:
xM(g) Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是()
Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是()
A.该反应的化学方程式是2HF (HF)2 (HF)2 |
| B.平衡时混合气体的平均摩尔质量是33.3 |
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时,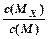 将增大 将增大 |
| D.M的沸点比同主族下一周期元素的气态氢化物沸点低 |