下列各表述与示意图一致的是 ( )
| A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 |
| B.图①中使用的NaOH的浓度为2 mol·L-1 |
| C.图②中曲线表示某反应过程的能量变化。若使用催化剂,B点会降低 |
| D.图②中物质A反应生成物质C,△H>0 |
下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是()
| A.Na和O2 | B.NaOH和CO2 |
| C.NaHCO3和NaOH | D.AgNO3和氨水 |
可逆反应a A(s)+b B(g)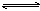 c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:
c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:
下列叙述正确的是
| A.达平衡后,加入催化剂则C%增大 |
| B.达平衡后,若升温,平衡左移 |
| C.化学方程式中c +d > a + b |
| D.达平衡后,增大压强有利于平衡向右移动 |
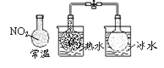
下列实验对应的结论正确的是
实验 |
 |
 |
 |
 |
| 结论 |
能组成 Zn、Cu原电池 |
能证明非金属性 Cl>C>Si |
白色沉淀 为BaSO3 |
说明反应 2NO2  N2O4 △H>0 N2O4 △H>0(无色) |
| 选项 |
A |
B |
C |
D |
将20gM物质、5gN物质、9gP物质混合加热发生化学反应,经充分反应后的混合物中含5gM物质、20gP物质还含有一种新物质Q。若M、N、P、Q的相对分子质量分别为30、20、44、18,它们之间发生反应的化学方程式是()
A.M + N = P + QB.M + 2N = 2P + Q
C.2M + N =2P + QD.2M + N = P + 2Q
三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是
| A.当它们的体积和温度、压强均相同时,三种气体的密度ρ(H2)>ρ(N2)>ρ(O2) |
| B.当它们的温度和密度都相同时,三种气体的压强 p(H2)>p(N2)>p(O2) |
| C.当它们的质量和温度、压强均相同时,三种气体的体积V(O2)>V(N2)>V(H2) |
| D.当它们的压强和体积、温度均相同时,三种气体的质量m(H2)>m(N2)>m(O2) |